【答案】
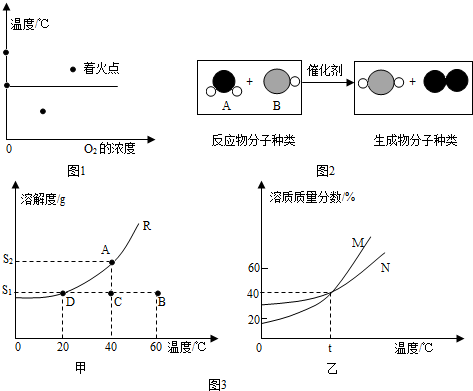
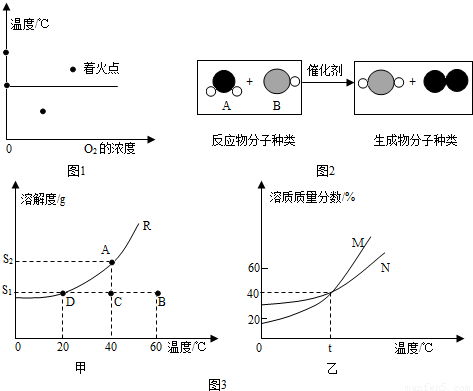
分析:(1)根据燃烧的条件(燃烧需要同时满足三个条件:①可燃物②氧气或空气③达到燃烧所需的最低温度即着火点)解答本题.
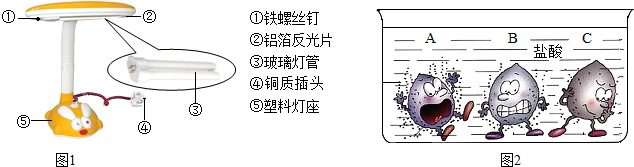
(2)根据图示为反应式配平.
(3)根据氯酸钾和氯化钾中钾元素和氯元素的质量比都为39:35.5,反应后氯元素的质量分数为35.5%,钾元素的质量分数为39%,所以氧元素的质量分数为1-35.5%-39%=25.5%,设原来这一定质量的氯酸钾为100g,分解的质量为x,列方程计算即可.
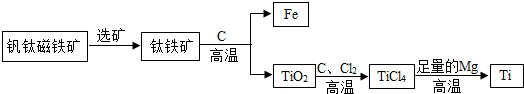
(4)①饱和溶液与不饱和溶液可通过改变温度、增减溶剂或溶质的方法实现互相转化,溶液状态的变化就使得曲线图中的点做相应地移动.
②根据题意,加水150克,加热溶解,同时蒸发掉50克水,冷却至T℃,这一系列变化后,相当于在T℃时用150g-50g=100g水分别去溶解50克M和80克N固体,判断此时的溶解情况;因此可根据饱和溶液的溶质质量分数随温度变化的曲线,算出T℃两物质的溶解度,然后判断此时100g水所能溶解两种物质的最大值,从而对所做的判断进行评价.
解答:解:(1)a点有可燃物,温度没达到着火点,没有氧气参与,故不会燃烧;
b点有可燃物,温度达到着火点,但没有氧气参与,故不会燃烧;
C点有可燃物,有氧气参与,温度没达到着火点,故不会燃烧;
d点温度在着火点上,氧气的浓度也达到,有可燃物,满足三个条件,会发生燃烧.
故答案为:d.
(2)根据图示可知,反应式中从左到右的系数分别是2、4、4、1.所以参加反应的化合物A与化合物B的分子个数比为1:2或2:4;生成物中单质分子与化合物分子的个数比为1:4.
故答案为:1:2或2:4;1:4.
(3)根据氯酸钾和氯化钾中钾元素和氯元素的质量比都为39:35.5,反应后氯元素的质量分数为35.5%,所以钾元素的质量分数为39%.生成物质中含有三种元素钾、氯和氧,所以氧元素的质量分数为1-35.5%-39%=25.5%,
设原来一定质量的氯酸钾为100g,分解的质量为x.
则:

×100%=25.5%
解的x=46.8g
所以已分解的氯酸钾的质量分数为

×100%=46.8%
故答案为:46.8%(46.8%至47%之间均可给分)
(4)①从溶液状态分析,A溶液为低温时饱和溶液,B溶液为高温时的不饱和溶液,可先将R溶液从A状态稀释到C状态,再将温度升高到60℃;也可先将A状态的R溶液温度降低到20℃,过滤后再将滤液温度升高到60℃.A状态由两种不同途径变到B状态时,两种途径都达到了相同的饱和程度,因此,溶质质量分数相等.
故答案为:a.可先将R溶液从A状态稀释到C状态,再将温度升高到60℃;
b.可先将A状态的R溶液温度降低到20℃,过滤后再将滤液温度升高到60℃:
C.是
②首先计算T℃时M、N两物质的溶解度:根据饱和溶液的溶质质量分数随温度变化的曲线,T℃时M、N两物质的饱和溶液的溶质质量分数相等都为40%,根据饱和溶液的溶质质量分数与溶解度的关系,可知此时两物质的溶解度相等,都为

×100g≈67g;
然后根据溶解度判断两物质在T℃时的溶解情况:T℃时M、N两物质的溶解度为67g,即此时100g水最多溶解M、N物质的质量都为67g,所以,加入的50gM可以全部溶解且形成不饱和溶液,加入的80gN不能全部溶解而成为饱和溶液;
综合以上分析,当降温到T℃时固体M不会析出,而固体N物质析出80g-67g=13g;由于此时M溶液不饱和溶液而N溶液为饱和溶液,因此两溶液的溶质质量分数也不相等;此温度下M、N两种物质的溶解度相同.
故ae正确,bcd不正确.
故答案为:ae.
点评:本题涉及到物质燃烧的条件、数学问题的计算,难度较大.解答(4)题时需要注意到所给出的曲线不是溶解度曲线而是饱和溶液的溶质质量分数随温度变化的曲线,可以使用饱和溶液中溶质质量分数与溶解度的关系进行数值转换.

 ×100%=25.5%
×100%=25.5% ×100%=46.8%
×100%=46.8% ×100g≈67g;
×100g≈67g;

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案