
����Ŀ����13�֣�A��B��C�ֱ���Zn��Cu��Ag���ֽ����е�һ�֡�Ϊ�˴����ǵĻ�����з���
������A�������B��C���Σ���������ʵ�������
��ش��������⣺
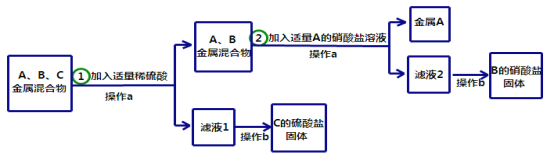
д���������з�����Ӧ�Ļ�ѧ����ʽ ��
A��B��C���ֽ����Ļ��˳���� > > ��
����b����Ҫ�õ��������������� ��
����A�� ���ѧʽ����ͬ����B���������� ��
��13�˵�пͶ�뵽98��ϡ������ǡ����ȫ��Ӧ�������ɵ������������Ƕ��٣�![]()
���𰸡���1��Zn + H2SO4 = ZnSO4 + H2�� ��2�� C��B��A ��3�� ��ֹҺ��ֲ����ȶ��ɽ�
��4��Ag Cu(NO3)2 ��5��0��4g
��������
�����������1�����ݽ����Ļ��˳�����ֽ���Zn��Cu��Ag��ֻ��п����ϡ���ᷴӦ�����Բ������з�����Ӧ�Ļ�ѧ����ʽ��Zn + H2SO4 = ZnSO4 + H2�����Ӷ������жϽ���CΪп
��2�����ݲ��������ڽ���Cu��Ag�������У�����A�������Σ�����û����˽���A�����Կ��ж�BΪͭ��A��ȻΪ������A��B��C���ֽ����Ļ��˳����C>B>A
��3������b�Ǵ���Һ�нᾧ�õ����壬��Ϊ�����������õ��������������ǣ����裬��ֹҺ��ֲ����ȶ��ɽ�
��4����������ķ�������AΪ������ѧʽΪ��Ag��B����������ͨ��ͭ����������Һ��Ӧ�õ�����Ϊ����ͭ����ѧʽΪ��Cu(NO3)2
��5�����ݻ�ѧ��Ӧ����ʽ��Zn + H2SO4 = ZnSO4 + H2����п��������������ϵ�������������������
�⣺������������Ϊx
Zn + H2SO4 = ZnSO4 + H2��
2
13g x
65:2=13g��x
X=0��4g


 ���ɿ��õ�Ԫ������ĩר����100��ϵ�д�
���ɿ��õ�Ԫ������ĩר����100��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(7��)��������(CaO2)������ˮ���������ȶ����ڳ�ʪ������ˮ�л����ų��������㷺Ӧ������ҵ��������ͼ���Դ���ʯ(��Al2O3������������ˮҲ�������������)��Ϊԭ����ȡCaO2������ͼ��
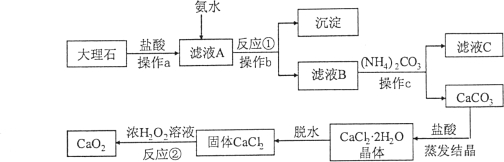
��1������a��b��c�����ƶ��� ��
��2������a��Ŀ���� ��
��3������ҺC�пɻ��յĸ���Ʒ�Ļ�ѧʽΪ ��
��4��д����Ӧ���Ļ�ѧ����ʽ ��
��5����Ӧ���Ļ�����Ӧ������ ��
��6���ڸ����������У���110kg����ʯ�Ƶ���72Kg�Ĺ������ơ���������ǹ����е���ģ��ɼ��������ʯ��CaCO3����������Ϊ ��(�������һλС��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ھ�ˮ������Ϊ��������ˮ���ɵĽ�״�����_________������ˮ�е����ʣ�ʹˮ���壻��������ˮ�������������ȣ�ClO2������Ԫ�صĻ��ϼ�Ϊ__________����ȥӲˮ�й����_______�������ӷ��ţ���Mg2+�Ϳɵõ���ˮ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(12��)��ͼ��ʾ��A��B��C��D�ֱ�Ϊ���������е�ijһ�֣�������̼����
��ʯ�Һ�����ͭ��ͼ��ֱ���������������ʻ�����Һ���������Ӧ��
��1����ʯ�ҵ�һ����;�� ����������ʯ����ˮ��Ӧ��ȡ
���û�ѧ����ʽ��ʾ����
��2�����������������������ܸ���������� ��
A��O2 ������B��SO2 ���� C��H2 ������ D��CO
������������ʯ��ˮ������ͭ��Һ��Ӧ�Ļ�ѧ����ʽΪ������������������������������
��4����DΪ������̼����Aһ���� �������ʵķ������A�������������������滻��������滻A��һ�������� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����10�֣���ͼ��ʵ���г�������װ�ã���ش��������⣺

��1��ָ�����б�ŵ��������ƣ�
��2�� ʵ����������غͶ������̼�����ȡ�������仯ѧ����ʽΪ
Ӧѡ�õ�ʵ�鷴Ӧװ��Ϊ ������ĸ��
��3����Ҫ��ȡ������̼��Ӧѡȡ�ķ���װ��Ϊ ������ĸ�����ܷ���C���ռ���
����̼�� �ش�˵������ ��
��4����ͼ��Fװ���ж�����;������Fװ���ռ�����������Ӧ�� ����a��b��ͬ��
��ͨ�룻ҽԺ�ڸ�������������ʱҲ�õ���������F��װ��ƿˮ����� ��ͨ
������,ͨ����װ�ÿ��Թ۲�����������ٶȡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ӧ�ú���Ӧ��ԭ��(�û�ѧ����ʽ��ʾ)��������Ӧ���Ͷ���ȷ����( )
A������θ������θ����� NaHC03+HCl=NaCl+H20+C02�� ���ֽⷴӦ
B����ҵ����ȡ����2H202![]() H20+02 �� �ֽⷴӦ
H20+02 �� �ֽⷴӦ
C���ܶ���ʯ�����ܽ�ķ�ӦCaC03+C02+H20=Ca(HCO3)2 ���Ϸ�Ӧ
D����֤ͭ�Ļ�Ա���ǿCu+2AgCl=CuCl2+2Ag �û���Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������е��Լ���ȥ������������������,�����Լ�������� ( )
A��KOH�л���K2CO3(ϡH2SO4) B��KCl�л���K2SO4(BaCl2)
C��KCl�л���K2CO3(ϡHCl) D��CO�л���CO2(NaOH)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�� (4��)����ͼƬ�е���Ϣ�ش��������⣺
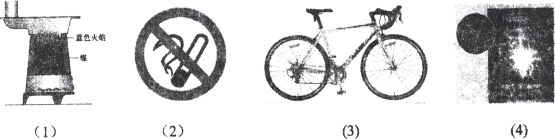
��1��ú¯��ú���Ϸ�����ɫ���棬��___________________________ȼ�ղ����ģ�
��2����ͼ��ĺ���___________________________��
��3�����г�֧�ܲ�ȡ�ķ����ʩ��___________________________��
��4����˿��������ȼ��ʱ������������___________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����7�֣��кͷ�Ӧ����ѧ��ѧ����Ҫ��ѧϰ���ݣ������ճ������ũҵ�������й㷺��Ӧ�á�
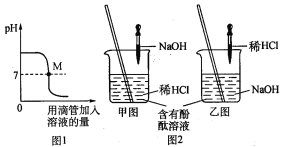
��1����ͼ��ʾ���������������Һ������Ӧ��������Һ��pH�ı仯���ߡ�
�������ͼ�л�ȡ��Ϣ���ش��������⣺
��ͼ1ͼ���ʾ���������������
Һ������Ӧ��������Һ��pH�仯�����и÷�Ӧ��ʵ������ǰ���ͼ2�е�_______������ң�ͼ��ʾ���еġ�
��������M���ʾ���������������Һ��Ӧ�������_______��
�����ձ����㵹20 g������2�η�̪��Һ����������Ϊ4.0%������������Һ��������ε�����������Ϊ7.3%��ϡ���ᣬ�ߵα���ֱ����Һ�պñ�Ϊ_______ɫΪֹ������ȥϡ����10 g����Ӧ����Һ��������������Ϊ_______��Ҫʹ��Ӧ�����Һ���20��ʱ�ı�����Һ����Ҫ�����Ȼ��ƹ����������_______g(�����ȷ��0.1 g)����֪��20��ʱ�Ȼ��Ƶ��ܽ��Ϊ36.0 g��
��2��Ϊ֤���кͷ�Ӧ�Ƿ��ȷ�Ӧ��ijС���������ͼ��ʾ��ʵ�������
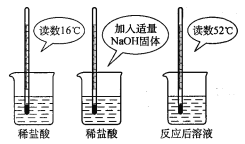
����ͼʾʵ�飬��ͬѧ��Ϊ��NaOH��ϡ�� �ᷢ�����кͷ�Ӧ�Ƿ��ȷ�Ӧ����ͬѧ��Ϊ����ͬѧ�ó�������۵����ݲ���ѧ��������__________��
��3��Ϊ̽��Ӱ���кͷ�Ӧ�ų��������ٵ����أ������ֽ���������ʵ�飺�ڱ��ΪA��B��C��D��E����ֻ�ձ��и�װ��36.5 g�������������ֱ�Ϊ5%��10%��15%��20%��25%�����ᣬ����������ֻ�ձ��зֱ����40 g 20%������������Һ�����������¶ȣ����ݼ�¼���£�
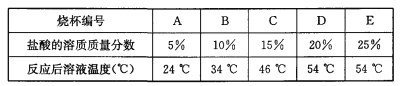
ʵ����ۣ�Ӱ����кͷ�Ӧ�ų��������ٵ�������_______��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com