
【题目】(8分)下图中的甲、乙、丙表示初中化学常见的物质,且甲、乙、丙为不同类别的化合物,乙属于氧化物。胃液中含有适量的甲,可帮助消化。图中“—”表示两端的物质问能发生化学反应;“→”表示物质间存在转化关系;部分反应物、生成物已略去。
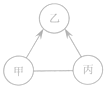
(1)写出甲的化学式 。
(2)①若乙在常温下为液体,丙可用来改良酸性土壤,则乙的化学式为 ,丙的化学式为 。
②若乙在常温下为气体,且可由甲与大理石反应得到,则乙的化学式为 ,丙能与①中的丙发生复分解反应,其化学方程式为 (写出一个即可)。
③写出①中的乙和②中的乙发生化合反应的化学方程式 为 。
【答案】(1)HCl
(2)①H2O Ca(OH)2
②CO2 Na2CO3+Ca(OH)2=CaCO3↓+2NaOH(其他合理答案均可)
③CO2+H2O=H2CO3
【解析】
试题分析:(1) 根据“胃液中含有适量的甲,可帮助消化”可知甲为盐酸,化学式为HCl。
(2)①若乙在常温下为液体,丙可用来改良酸性土壤,可知乙为水,丙为氢氧化钙。化学式分别为H2O、Ca(OH)2
②若乙在常温下为气体,且可由甲与大理石反应得到,则乙为二氧化碳,化学式为CO2,丙能与①中的丙(氢氧化钙)发生复分解反应。且图示中丙甲(盐酸)两物质可进行反应,则丙可为碳酸钠(碳酸钾等合理答案也可);碳酸钠与氢氧化钙反应的化学方程式为Na2CO3+Ca(OH)2=CaCO3↓+2NaOH。
③①中的乙为水;②中的乙为二氧化碳。二者发生化合反应的化学方程式CO2+H2O=H2CO3。


科目:初中化学 来源: 题型:
【题目】(12分)甲、乙两同学在学完酸的化学性质后,做了如下实验:

【观察与讨论1】甲同学在做实验时观察到的明显现象是 ① 。再滴加无色酚酞溶液,无明显现象(已知CaCl2溶液呈中性)。
【观察与讨论2】乙同学在做实验时开始没有观察到气泡产生,于是对碳酸钠能否与盐酸反应表示怀疑。甲同学通过查阅资料得知:在碳酸钠溶液中滴加少量稀盐酸,先发生反应Na2CO3+HCl=NaCl+NaHCO3,继续滴加稀盐酸,再发生反应NaHCO3+HCl=NaCl+H2O+CO2↑。所以甲同学认为,乙同学实验时还应 ② ,才能观察到有气泡产生。
【观察与讨论3】甲同学先将废液缓慢倒入一洁净的废液杯中,乙同学在观察到气泡产生后,也将实验废液缓慢倒入该废液杯中,没有观察到明显现象。经过讨论确定,甲同学的试管中废液含有的溶质一定有 ③ ,乙同学的试管中废液含有的溶质一定有 ④ (均写化学式)。
为了处理实验后产生的废液,甲、乙同学决定对废液杯中最终废液溶质的成分进行探究。
【提出问题】最终废液中含有什么溶质?
【猜想与假设】猜想1:废液中含有 ⑤ (写化学式)两种溶质。
猜想2:废液中含有 ⑥ (写化学式)三种溶质。
猜想3:废液中含有NaHCO3、CaCl2、 NaCl三种溶质。
【活动与探究】甲、乙同学为了验证猜想,进行了如下实验:
甲同学实验:取少量废液于试管中,向其中滴加盐酸,无气泡产生。
乙同学实验:取少量废液于试管中,向其中滴加紫色石蕊试液,溶液变红色。
【结论与反思】(1)猜想 ⑦ (填“1”或“2” 或“3”)正确。
(2)要得到相同的结论,还可采用很多种方法。如加入氧化铁粉末,可观察到溶液呈 ⑧ 色,该反应的化学方程式为 ⑨ 。
【表达与交流】甲、乙同学确认了最终废液中溶质的成分,若直接排放,可能造成的危害是
⑩ ,你认为处理该废液的方法是 。
查看答案和解析>>
科目:初中化学 来源: 题型:
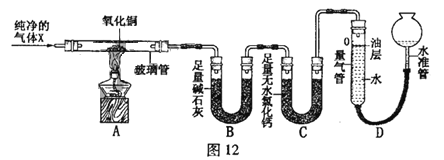
【题目】(10分)为探究气体X的组成,某兴趣小组进行图12所示实验(固定装置未画出)。
【资料在线】
(1)加热条件下,气体X能与氧化铜反应生成铜、水和氮气。
(2)碱石灰为固体氢氧化钠和氧化钙的混合物,不与气体X反应。
无水氯化钙可吸收气体X。
(3)本实验条件下,氮气密度为1.15g·L-1,装置内空气中的水与二氧化碳对相关数据测定的影响可忽略不计。
【实验步骤】
(1)连接仪器,并检查装置气密性。
(2)取一定量氧化铜,准确称得其质量为2.40g。
(3)按图12所示装入药品,测量并记录相关数据Ⅰ(见表1)。
(4)连接A、B、C装置, 将气体X缓缓通入一段时间后,连接上D装置,读数后开始加热。当A装置中氧化铜反应完全,停止加热,继续通入气体 X至玻璃管冷却,再次测量并记录相关数据Ⅱ(见表1)。
【实验装置】
【相关数据】

【回答问题】
(1)B装置中氧化钙吸水的原理为 (用化学方程式表示)。
(2)实验过程中,当观察到 ,说明氧化铜已反应完全,停止加热,继续通入气体X至玻璃管冷却的目的是 。
(3)分析实验测量的数据,生成水的质量为 g,氧化铜中氧元素的质量为 g。
由此推知,气体X中一定 (填“有”或 “没有”)氧元素。
(4)通过计算推导出气体X的化学式。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验中学化学兴趣小组为测定某石灰石样品(杂质不溶于水,也不与酸反应)中碳酸钙的质量分数,进行如图所示的实验。
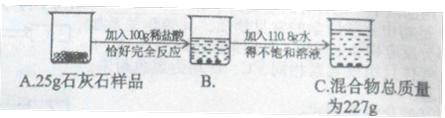
请根据以上信息计算:
(1)样品中碳酸钙的质量分数?
(2)C烧杯中溶液的溶质质量分数?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列离子能在pH=2的水溶液中大量共存的是( )
A.SO42-、NO3-、K+、OH- B.HCO3-、Cl-、SO42-、Na+
C.Cl-、NO3-、K+、Na+ D.NH4+、Cl-、OH-、K+
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(11分)煤、石油和天然气等化石燃料是目前人类使用的最主要燃料,也是重要的化工原料。
(1)石油中主要含有 两种元素(填写元素符号);天然气的主要成分是 (填写化学式)。
(2)化石燃料属于 (选填“可再生”或“不可再生”)能源,其燃烧排放的大量二氧化碳会引起全球气候变暖。一种新的处理方法是将二氧化碳气体通入含有长石(地壳中最常见的矿石,含量高达60%)成分的水溶液里,其中一种反应的化学方程式: KAlSi3O8+CO2+2H2O==KHCO3+X+3SiO2↓,则X的化学式为 。
(3)工业上,煤炭燃烧前进行粉碎的目的是 。煤隔绝空气加强热得到的焦炭,是冶铁的重要原料。为了测定某赤铁矿中氧化铁的质量分数,化学兴趣小组的同学设计了两种实验方案(假设该赤铁矿中的杂质既不溶于水,也不发生反应)。
方案I 取8.00g赤铁矿粉,加入足量稀硫酸,完全反应后过滤,得到1.60g滤渣。则赤铁矿粉中氧化铁的质量分数为 。
方案Ⅱ 如图所示,取8.00g赤铁矿粉与过量的焦炭粉混合后加强热,充分反应。测得氢氧化钠溶液反应前后质量增加了1.32g。如果产生的二氧化碳被氢氧化钠溶液完全吸收,根据所学反应3C+2Fe2O3△4Fe+3CO2↑计算,赤铁矿粉中氧化铁的质量分数为 。
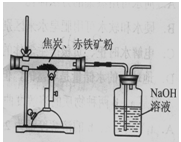
[实验反思]方案Ⅱ中硬质玻璃管内原有的空气对实验结果有影响,这会导致测出的氧化铁的质量分数 (选填“偏大”、“偏小”或“不变”)。
[实验分析]方案I测出的氧化铁的质量分数明显大于方案Ⅱ测出的结果,可能的原因是 (写出一种即可)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某实验小组对实验室制取氢气的反应原理进行探究。
【知识回顾】能产生氢气的化学反应有: ①水电解 ②活泼金属与酸反应
【讨论交流】反应①的化学方程式 ;同学们讨论后认为该反应不适用于实验室制取氢气。
【实验探究】为了探究哪种物质更适合用于实验室制取氢气,大家设计了如下实验:
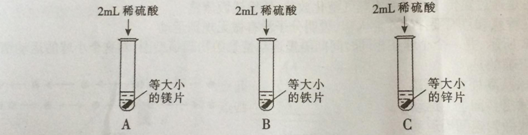
【分析与结论】填写实验报告。
实验 | 实验现象 | 实验结论 |
A | 剧烈反应,迅速产生大量气泡,试管外壁 | 反应速率过快,气体不便收集,不能用于实验室制取氢气 |
B | 缓慢产生少量气泡 | 反应速率过慢,不能用于实验室制取氢气 |
C | 较快产生大量气泡,试管外壁发热 |
通过实验得出,适合实验室制取氢气的化学反应方程式为 ;
【知识拓展】(1)确定实验室制取气体的反应原理时,要考虑诸多因素,如反应的快慢、收集的难易、 等。
(2)用稀盐酸制取氢气时,制得的气体中可能会增加的杂质为 。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】右图为硝酸钾和氯化钠两种物质的饱和溶液的质量分数随温度变化的曲线,M、N分别是50℃时硝酸钾和氯化钠质量分数随温度变化曲线上的点。分析曲线得到的以下结论中,正确的是
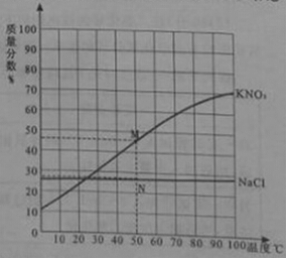
A.50℃时,M、N之间任一点表示的溶液一定是硝酸钾和氯化钠的饱和溶液
B.50℃时,其他条件不变,升温至60℃,M点向右平移,硝酸钾的溶解度增大
C.50℃时,其他条件不变,降温至40℃,N点向右平移,氯化钠的溶解度减小
D.50℃时,向两饱和溶液添加溶质,M点不动,硝酸钾和氯化钠的溶解度增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com