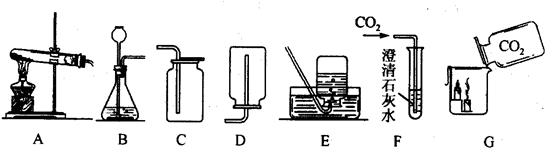
【答案】
分析:(1)根据高锰酸钾受热分解生成锰酸钾、二氧化锰和氧气的特点选择发生装置及书写化学方程式;根据实验注意事项分析棉花的作用;
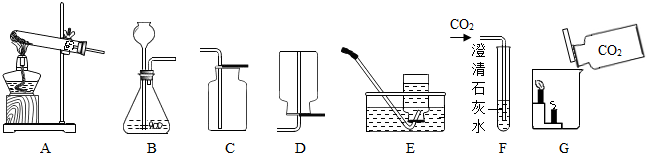
(2)实验室制取二氧化碳的药品是石灰石和稀盐酸,根据反应物的状态和反应条件选择发生装置;根据二氧化碳的密度和溶解性选择收集装置;
(3)根据二氧化碳能够使澄清的石灰水变浑浊分析并写出反应的方程式;
(4)根据实验现象分析二氧化碳的性质及用途;
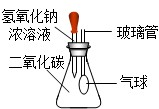
(5)根据信息提供的反应物的状态和反应条件选择发生装置;
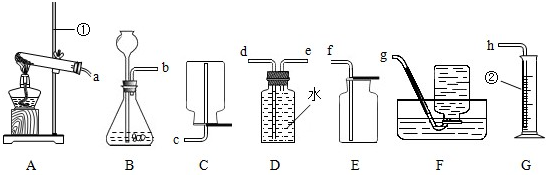
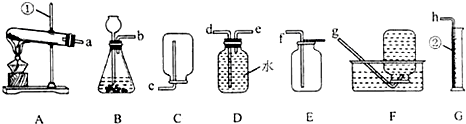
解答:解:(1)加热高锰酸钾的发生装置的特点属于固体加热型,故选择A装置;
反应的方程式为:2KMnO
4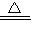
K
2MnO
4+MnO
2+O
2↑;因为高锰酸钾小颗粒在加热时会进入导气管而堵塞导管,故应该在试管口放一团棉花;
(2)实验室制取二氧化碳的药品是石灰石和稀盐酸,反应物的状态和反应条件属于固液常温型,故选择的发生装置
是:B;因为二氧化碳易溶于水,密度比空气大,故采用的收集方法是向上排空气法,相应的收集装置是:C;
(3)二氧化碳能够使澄清的石灰水变浑浊,反应的方程式为:Ca(OH)
2+CO
2=CaCO
3↓+H
2O;
(4)根据蜡烛能够熄灭说明二氧化碳不能燃烧,也不支持燃烧,而下面的蜡烛先熄灭说明二氧化碳的密度比空气大;故根据二氧化碳的性质可以用来灭火;
(5)根据题中提供的制取硫化氢的药品和反应条件,选择的发生装置属于固液常温型的B装置.
故答案为:(1)A 2KMnO
4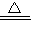
K
2MnO
4+MnO
2+O
2↑ 防止加热时高锰酸钾粉末进入导气管 (2)B、C
(3)澄清的石灰水变浑浊(或有白色沉淀生成) Ca(OH)
2+CO
2=CaCO
3↓+H
2O
(4)不能燃烧,也不支持燃烧,且密度比空气大 灭火
(5)B 反应物状态是固体和液体且反应不需要加热
点评:本题考查了气体的制取和收集及二氧化碳的性质,关键是明确反应的原理及发生装置和收集装置的特点,能够考查学生的分析问题能力,运用知识的能力.

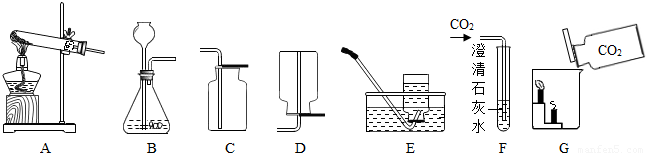
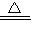 K2MnO4+MnO2+O2↑;因为高锰酸钾小颗粒在加热时会进入导气管而堵塞导管,故应该在试管口放一团棉花;
K2MnO4+MnO2+O2↑;因为高锰酸钾小颗粒在加热时会进入导气管而堵塞导管,故应该在试管口放一团棉花;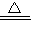 K2MnO4+MnO2+O2↑ 防止加热时高锰酸钾粉末进入导气管 (2)B、C
K2MnO4+MnO2+O2↑ 防止加热时高锰酸钾粉末进入导气管 (2)B、C

 阅读快车系列答案
阅读快车系列答案