CD
分析:根据充分反应后生成18g水,利用化学反应方程式可知,2g氢气和16g氧气恰好完全反应生成18g水,则20g混合气体有剩余的气体存在,则有两种可能:①剩余气体为氢气;②剩余气体为氧气来分析解答.
解答:氢气和氧气反应的化学反应方程式为
2H
2+O
2
2H
2O
4 32 36
x y 18g
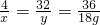
,
解得x=2g,y=16g,
①若剩余气体为氢气,则氢气的质量为2g+(20g-18g)=4g,即混合气体中有4g氢气和16g氧气,两者质量比是
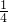
,故D正确;
②若剩余气体为氧气,则氧气的质量为16g+(20g-18g)=18g,即混合气体中有2g氢气和18g氧气,两者质量比是
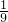
,故C正确;
故选CD.
点评:本题考查学生利用化学反应方程式的计算来分析混合物的成分,学生应能利用化学反应判断恰好完全反应的量,要注意过量计算过程的思维训练.


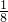
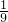
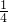
 2H2O
2H2O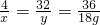 ,
,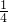 ,故D正确;
,故D正确;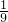 ,故C正确;
,故C正确;
