
【题目】在宏观、微观、符号之间建立联系是化学学科的特点,下图是在点燃条件下,燃料A和足量B反应生成C和D的微观示意图,其中相同的球代表同种原子
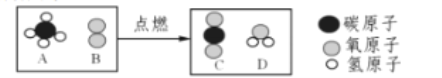

(1)上图所示反应说明,___________ 是保持物质化学性质的最小粒子;
(2)A的相对分子质量是_______________,A中碳、氢元素的质量比为____________;
(3)该反应的化学方程式为 __________________________________________;
(4)在该反应中,生成C和D的质量比为 ______(结果用最简整数比);
(5)若生成物中含有的氧原子总数为n个,则参与反应的B分子数为_________________
(6)半水煤气的主要成分是H2、CO、CO2、N2和水蒸气,工业上用半水煤气合成氨的过程如图所示。下列说法不正确的是____________
A.半水煤气无色无味 B.反应①是CO与水蒸气发生反应
C.可以用水脱除CO2 D.①和③的反应类型相同
【答案】分子 16 3∶1 CH4+2O2 ![]() CO2+2H2O 11∶9
CO2+2H2O 11∶9 ![]() CD
CD
【解析】
(1)不同物质的分子化学性质不同,上图所示反应说明,分子是保持物质化学性质的最小粒子,故填分子;
(2)由图示可知A的化学式为CH4,相对分子质量是12+4=16,故填16;A中碳、氢元素的质量比=12∶4=3∶1,故填3∶1;
(3)由图可知该反应是甲烷燃烧生成二氧化碳和水的反应,化学方程式故填CH4+2O2 ![]() CO2+2H2O;
CO2+2H2O;
(4)C是二氧化碳,D是水,根据化学方程式CH4+2O2 ![]() CO2+2H2O可知生成C和D的质量比=11∶9,故填11∶9;
CO2+2H2O可知生成C和D的质量比=11∶9,故填11∶9;
(5)根据质量守恒定律,若生成物中含有的氧原子总数为n个,则参与反应的B分子数为![]() ,因为每个B分子中含有2个氧原子,故填
,因为每个B分子中含有2个氧原子,故填![]() ;
;
(6)
A、半水煤气的主要成分是H2、CO、CO2、N2和水蒸气,都是无色无味的气体,故不符合题意;
B、反应①是CO与水蒸气发生反应,生成二氧化碳和氢气,故不符合题意;
C、二氧化碳可溶于水,溶解能力为1:1,水不能大量吸收二氧化碳,二氧化碳和水反应生成的碳酸不稳定,易分解生成二氧化碳和水,导致二氧化碳除不尽,故符合题意;
D、反应①是CO与水蒸气发生反应,生成二氧化碳和氢气,不属于化合反应,反应③属于化合反应,故符合题意;故填CD。


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:初中化学 来源: 题型:
【题目】据悉宣城高铁将于2020年开通,它将极大方便宣城人出行,也将为宣城发展带来机遇(如图所示)。钢铁和铝合金是建造高铁列车的主要金属材料。

(1)铝化学性质比铁活泼但比铁耐腐蚀,原因是___。在铁中熔入镍铬的目的是___。
(2)用一氧化碳和赤铁矿(主要成分为Fe2O3)炼铁的化学方程式是___。
(3)某生铁和钢的样品中,主要元素的质量分数如下表所示:
Fe | C | S | |
生铁 | 95.94% | 3.52% | 0.06% |
钢 | 98.97% | 0.45% | 0.03% |
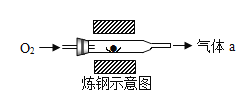
结合数据及炼钢示意图(上图所示)生铁炼钢时通入过量氧气的目的是___,气体a的成分是___。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】A~J均为初中常见化学物质:它们之间的转化关系如图所示,部分产物已省略。已知A是人体胃酸的主要成分,B是由四种元素组成的盐类,C是一切生命生存所必须的物质,E是厨房重要的调味品。请回答下列问题:
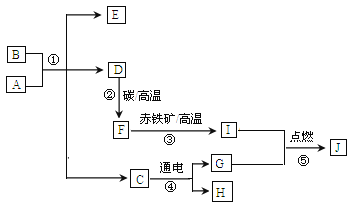
(1)物质F____________,H_________(用化学式表示)。
(2)A和B反应的化学方程式为_____________。
(3)①~⑤属于分解反应的是________________。
(4)A和J反应可生成两种不同盐类,两者所含元素种类相同,但其比例不同,则A何J反应的化学方程式为_______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图为A、B、C三种物质的溶解度曲线。请根据图回答:
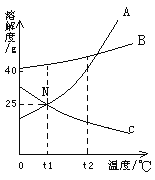
(1)N点的意义:______
(2)t1℃时,在25g水中放入20g A 物质,形成的A溶液溶质质量分数是_________,要使该溶液变为不饱和溶液可采用的方法 ________(填一种即可)
(3)t2℃时,将等质量的A、B、C三种物质的饱和溶液,降温至t1℃,析出晶体最多的是______,没有晶体析出的是______。
(4)t2℃时,将等质量的A、B、C三种物质的饱和溶液,均恒温蒸发等质量的水,析出晶体由多到少的顺序为________________;
(5)欲将混有少量B的A物质提纯,可以采取的措施是____________________。
(6)t2℃时,将A、B、C的饱和溶液降温至t1℃,A、B、C的溶液溶质质量分数大小关系是_______________。
(7)上图中可能是气态物质的溶解度曲线是________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】通常情况下铜不与稀硫酸反应,但将一小块铜片加入装有过量稀硫酸的烧杯中,在不断通入O2并加热的条件下,可以发生如下反应:2Cu+2H2SO4(稀)+O2![]() 2CuSO4+2X,下列说法正确的是( )
2CuSO4+2X,下列说法正确的是( )
A. 反应后烧杯中的物质只含有CuSO4和H2O
B. 生成物X的化学式是H2O2
C. 反应后溶液由无色变为蓝色
D. 反应前后烧杯内液体的质量不变
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】按要求完成下列填空。
(1)“化学为繁杂物质分类”,分类是学习和研究化学物质常用的一种方法。按要求从二氧化碳、氢氧化钙、氧化钙、碳酸、硫酸钾、碳酸氢钠中选择合适的物质,将其化学式填写在下列横线上。
①一种可用于人工降雨的氧化物_________②一种可用作农作物化肥的盐________
③一种可用于制汽水的酸__________ ④一种可改良酸性土壤的碱__________
(2)“化学为生命密码解锁”。DNA承载着生命遗传密码,DNA初步水解可得腺嘌呤(C5H5N5)、胞嘧啶(C4H5ON3)等,它们都属于_________(填“氧化物”“混合物”“化合物”“无机物”“有机物”中的两项),胞嘧啶(C4H5ON3)中碳、氧元素的质量比为__________(填最简整数比)。
(3)“化学为人类提供动力”。在能源领域,氢气,可燃冰(主要成分为甲烷(CH4)),一氧化碳等都可以用作燃料。其中氢气是一种有发展前途的新型清洁能源,原因是____(用文字叙述)。可燃冰是“未来能源”,其主要成分燃烧的化学方程式为________。
下列关于CO的说法错误的是________(填序号)。
A CO是无色无味的气体
B CO是绿色植物光合作用的原料之一
C CO具有毒性和还原性
D CO可与人体血液中的血红蛋白结合
(4)“化学为环境提供保障”。工厂化石燃料燃烧产生的废气和汽车尾气除污染大气外,还是导致酸雨的重要原因,请简述酸雨形成的过程:____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国高铁、航空航天、手机制造等都已经跻身世界一流水平,根据下列材料的应用回答问题。
应用 | “复兴号” 高铁车轮 | “鲲龙”水陆两栖飞机零部件 | 华为折叠手机屏幕 |
用到的材料 | 高速钢 | 钛合金、铝合金 | 聚酰亚胺塑料 |
(1)上述材料中属于有机合成材料的是_________,属于金属材料的是_________(写一种即可)。
(2)飞机外壳用钛合金、铝合金的优点是_________。
(3)在对高铁钢轨中的缝隙进行焊接时,常用铝和氧化铁在高温条件下反应生成熔融状态下的铁和另一种氧化物。该反应的化学方程式为________,反应基本类型是________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是a、b、c三种物质(均不含结晶水)的溶解度曲线,请你回答:
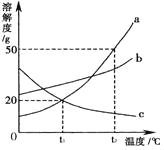
(1)0℃时,a、b、c三种物质中溶解度最大的是_____;
(2)将t1℃时三种物质的饱和溶液升温至t2℃时,有晶体析出的是_____;
(3)t2℃时,将30g a物质加入到50g水中充分溶解,所形成溶液的质量是_____g。
(4)t2℃时,等质量的a和b配制成饱和溶液时所需水的质量_____(填“a=b”或“a>b”或“a<b”)
(5)将t1℃时a、b、c三种物质饱和溶液的温度升高到t2℃时,三种溶液的溶质质量分数大小关系是_____(填选项序号)。
A c>a=b B a=b>c C a>b>c D b>a>c
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】过氧化钙(CaO2)是一种白色无毒的固体,微溶于水,溶于酸,能杀菌消毒,广泛用于果蔬保鲜、空气净化、污水处理等方面。以下是一种制备过氧化钙的实验方法:
(Ⅰ)氨气的制备
(查阅资料)
①实验室常用加热氯化铵和熟石灰固体混合物的方法制取氨气;
②氨气极易溶于水,所得溶液称为氨水。
③碱石灰的主要成分是氧化钙和氢氧化钠的混合物。
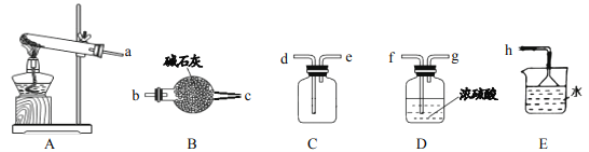
(1)实验室制取氨气的化学方程式_____。
(2)如需收集一瓶干燥的氨气,请选择上图中合适的装置,装置连接顺序为:a→_____→_____→_____→_____→h(按气流方向,用小写字母填空)。
(Ⅱ)碳酸钙的制备

(1)铁的氧化物主要成分为氧化铁,写出氧化铁和盐酸反应的化学方程式_____。
(2)步骤①加入双氧水的目的是使溶液中的Fe2+转化为Fe3+,加入氨水使铁离子形成沉淀,则滤渣的主要成分为_____(填化学式),小火煮沸的作用是使沉淀颗粒长大,有利于_____。
(Ⅲ)过氧化钙的制备
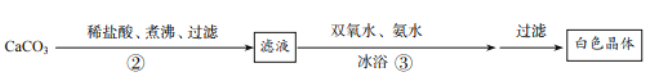
(1)步骤②的具体操作为逐滴加入稀盐酸直至过量。将溶液煮沸的作用是_____。
(2)步骤③是氯化钙和过氧化氢反应制取过氧化钙,则反应的化学方程式为_____,加入氨水的目的是_____,该反应需要在冰浴下进行,原因是_____。
(3)某同学认为,将石灰石煅烧后,直接加入双氧水反应,过滤后即可得到过氧化钙产品,使用该制备工艺的主要缺点是_____。
(4)已知CaO2在350℃迅速分解生成CaO和O2。下图是实验室测定产品中CaO2含量的装置(夹持装置省略)。
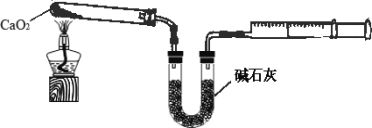
若所取产品质量是0.5g,测得气体体积为60.0mL(该温度下氧气密度为1.6g/L),则产品中CaO2的质量分数为多少_____(写出计算过程)?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com