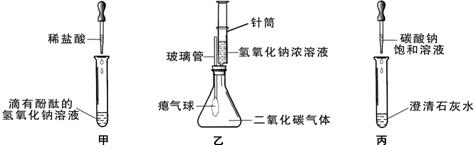
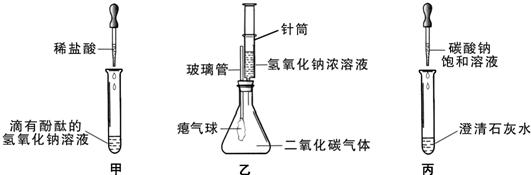
23、同学们在学习碱的化学性质时,进行如图所示的实验.

(1)A实验注入氢氧化钠溶液后,可观察到的现象是
气球变大
;
(2)C实验中观察到试管内有白色沉淀产生,写出该反应的化学方程式:
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
.
(3)实验结束后,同学们将A、B、C三个实验的废液倒入同一个干净的废液缸中,最终看到废液浑浊并呈红色,产生疑问.
【提出问题】废液中含有哪些物质?
【交流讨论】①小明通过实验观察,认为废液中一定含有的物质是水、氯化钠、指示剂和
碳酸钙
(写物质名称);一定不含有的物质是
盐酸
(写物质名称).
②还含有能使废液呈碱性的物质.能使废液呈碱性的物质是什么?
同学们有如下猜想:
小明认为:只有碳酸钠
小东认为:只有氢氧化钠
小刚认为:是氢氧化钠和碳酸钠
你认为还有可能是
氢氧化钙
(写一种猜想).
【实验设计】小聪想用氯化钙溶液来验证小明、小东、小刚的猜想.通过查阅资料获悉氯化钙溶液呈中性,并设计如下实验.

若溶液呈红色,则
小刚
的猜想正确;若溶液呈无色,则
小明
的猜想正确.
【反思拓展】在分析化学反应后所得物质的成分时,除了考虑生成物外还需要考虑
反应物是否有剩余
.





 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案