


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
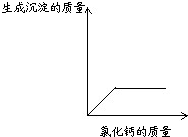 18、某化学兴趣小组,在学习碱的化学性质时,进行了如图所示的实验.
18、某化学兴趣小组,在学习碱的化学性质时,进行了如图所示的实验.
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
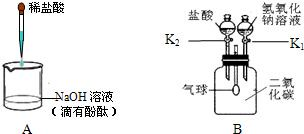

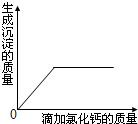
查看答案和解析>>
科目:初中化学 来源: 题型:
| 实 验 过 程 | 实验现象 | 实 验 结 论 |
| 向盛有少量NaCl溶液的试管中滴入酚酞试液,振荡 | 溶液无明显 变化 |
查看答案和解析>>
科目:初中化学 来源: 题型:
 17、已知M、N分别是稀盐酸、氢氧化钠溶液中的一种.某化学兴趣小组同学在一定量的M中不断滴加N,并测定所得溶液的pH值,如图所示.
17、已知M、N分别是稀盐酸、氢氧化钠溶液中的一种.某化学兴趣小组同学在一定量的M中不断滴加N,并测定所得溶液的pH值,如图所示.| 实验步骤 | 实验现象 | 结论 |
| 取少量该溶液,向其中滴加石蕊溶液(合理即可) | 溶液变红 | 为c处溶液,并推知溶液中的离子有 Na+、H+、SO42- (填写离子符号) |
查看答案和解析>>
科目:初中化学 来源: 题型:
 已知M、N分别是稀硫酸、氢氧化钠溶液中的一种.某化学兴趣小组同学在一定量的M中不断滴加N,并测定所得溶液的pH,如图所示.
已知M、N分别是稀硫酸、氢氧化钠溶液中的一种.某化学兴趣小组同学在一定量的M中不断滴加N,并测定所得溶液的pH,如图所示.| 实验步骤 | 实验现象 | 结论 |
| 取少量该溶液,加入适量的 石蕊试液 石蕊试液 |
试液变红 试液变红 |
为c处溶液,并推知原溶液中的离子有 Na+、H+、SO42- Na+、H+、SO42- (填写离子符号) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com