
 ,一个氧离子中有8个质子.
,一个氧离子中有8个质子. 分析 (1)氧化铝中铝元素显+3价,氧元素显-2价,写出其化学式即可.
(2)离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其离子符号前加上相应的数字.
(3)粒子结构示意图中,圆圈内数字表示核内质子数,据此进行分析解答.
解答 解:(1)氧化铝中铝元素显+3价,氧元素显-2价,其化学式为:Al2O3.
(2)由离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其离子符号前加上相应的数字.3个铝离子可表示为3Al3+.
(3)粒子结构示意图中,圆圈内数字表示核内质子数,由氧离子的结构示意图,圆圈内的数字是8,则一个氧离子中有8个质子.
故答案为:(1)Al2O3;(2)3Al3+;(3)8.
点评 本题难度不大,掌握常见化学用语(化学式、粒子结构示意图、离子符号等)的书写方法、注意离子符号与化合价表示方法的区别等是正确解答此类题的关键.


科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
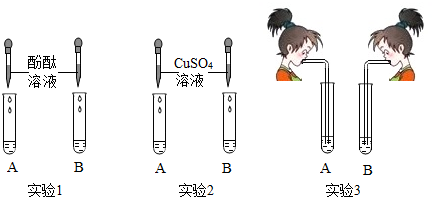
| 实验 | 实验现象 | 结论 |
| 取B中少量溶液,加入澄清石灰水至不再产生沉淀为止,过滤后取上层清液,向其中加几滴酚酞试液 | 产生白色沉淀溶液呈现红色 | 猜想3成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 在点燃的条件下,细铁丝在氧气中剧烈燃烧,火星四射,生成黑色的四氧化三铁 | |
| B. | 在点燃的条件下,硫在氧气里燃烧,发出蓝紫色火焰,生成无色无味的气体 | |
| C. | 铁、硫、酒精在氧气中的燃烧都是化合反应 | |
| D. | 物质与氧气的反应属于氧化反应,氧气具有氧化性 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 质子数不同 | B. | 中子数不同 | ||
| C. | 最外层电子数不同 | D. | 原子核外电子层数不同 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com