
【题目】【2016年上海市】实验室制备二氧化碳的实验如下:
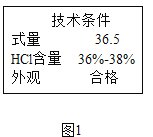
①市售浓盐酸的标签局部见下图,该盐酸中HCl质量分数的范围是 。为使制备过程中二氧化碳平稳地产生且较纯净,应将该浓盐酸 。
②用甲装置制备二氧化碳,选择的固体药品是 (选填编号)。
A.粉末状石灰石 B.块状大理石 C.粉末状熟石灰 D.块状生石灰

③控制所加盐酸的量,使反应时甲装置内液面位于 处(选填“x”或“y”)为宜。
④收集二氧化碳,应将甲的 处与乙的 处连接(选填有关编号)。
⑤写出用澄清石灰水检验二氧化碳的化学方程式 .
⑥反应生成了0.1mol二氧化碳,求稀盐酸中参与反应的HCl的质量。(根据化学方程式列式计算) 。
【答案】①36%---38% 稀释 ② b ③y ④ f、j ⑤ CO2+Ca(OH)2=CaCO3↓+H2O ⑥7.3 g
【解析】①根据标签可知,该盐酸中HCl质量分数的范围是36%---38%,反应物浓度越大反应速度越快,若用浓盐酸制取二氧化碳,反应速度太快,并且制得的二氧化碳中含有氯化氢气体,故应该将浓盐酸稀释。
②制取二氧化碳用大理石或石灰石与稀盐酸,反应物之间接触面积越大反应速度越快,用粉末状石灰石反应速度太快,不易控制,应该选择块状的固体,故选b
③如果液面不低于y,反应时会有液体进入导气管
④f是导气管,二氧化碳的密度比空气的密度大,进入乙中后空气被赶到上方空间,k有利于空气导出,是出气管,那么j是进气管,故f与j 连接
⑤ 检验二氧化碳用澄清石灰水,CO2+Ca(OH)2=CaCO3↓+H2O
⑥设稀盐酸中参与反应的HCl的质量是x
CaCO3+2HCl=CaCl2+H2O+CO2↑
73g 1mol
x 0.1mol
![]() =
= ![]() 解得x=7.3 g
解得x=7.3 g
答:稀盐酸中参与反应的HCl的质量是7.3 g


 互动课堂系列答案
互动课堂系列答案科目:初中化学 来源: 题型:
【题目】【2016年江苏省扬州市】CO2的资源化利用日趋成为研究热点。
(1)某小组查阅资料发现:①CO2与H2能在催化剂表面反应生成CH4与H2O;②CH4在高温下能与CuO反应。为探究上述反应,设计如下装置:
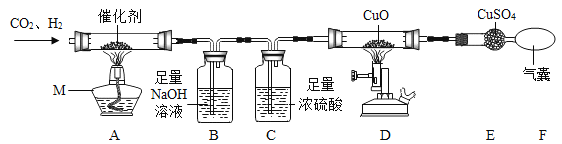
①仪器M的名称是 ,装置B中反应的化学方程式为 。
②设计装置C的目的是 ,若要证明D中有CO2生成,则需在E、F之间增加盛有 溶液的洗气瓶。
③一段时间后,装置D中黑色固体变红,E中白色固体变蓝,该小组由此得出结论:以上实验证明CH4在高温条件下能与CuO反应。你是否同意他们的结论? (填“同意”或“不同意”),理由是 。
(2)CH4、乙炔(C2H2)和丙烷(CH3H8)都能在空气中燃烧,但是仅C2H2燃烧时有浓烟。试从物质组成的角度分析其燃烧现象不同的原因是: 。CH4燃料电池具有洁净、高效的特点,其工作时主要是将 能转化为电能。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化合物完全燃烧,生成二氧化碳和水,则对该化合物的组成说法正确的是( )
A.只含碳氢元素 B.一定含碳氢可能含氧
C.一定含碳氢氧 D.一定含碳氧可能含氢
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】把一定质量的a,b,c,d四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得反应后各物质的质量如下,下列说法中正确的是( )
物质 | a | b | c | d |
反应前质量/g | 6.4 | 3.2 | 4.0 | 2.6 |
反应后质量/g | 5.2 | x | 7.2 | 2.6 |
A.a和c是反应物 B.d一定是催化剂
C.X=2.0g D.该反应是化合反应
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】从分子的角度分析并解释下列事实,不正确的是( )
选项 | 事实 | 解释 |
A | 碘酒是混合物 | 由不同种分子构成 |
B | 端午时节粽飘香 | 分子在不断运动着 |
C[ | 气体受热膨胀 | 温度升高,分子自身体积增大 |
D | 固体碘受热升华 | 碘分子间的间隔变大 |
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】【2016年山东省烟台市】久置的铜制品表面能生成绿色的铜锈[主要成分为Cu2(OH)2CO3],某化学兴趣小组对铜生锈的条件进行了以下探究。
【提出猜想】根据铜锈的组成元素推测,铜生锈可能是铜与空气中的二氧化碳、水等物质反应的结果。
【实验设计】兴趣小组同学取打磨光量的铜丝,设计了如图所示的四个实验。
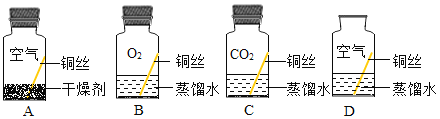
【现象分析】若干天后,发现只有D瓶中的铜丝出现绿色的铜锈,其他瓶中的铜丝均无铜锈出现。
(1)实验B、C瓶中所使用的蒸馏水是经煮沸后迅速冷却的蒸馏水,其目的是 。
(2)B瓶与D瓶中的现象对比,可以得出的结论是 。
【实验结论】由上述四个实验可分析得出,铜生锈是铜与空气中的 共同作用的结果。
【拓展探究】以锈蚀严重的废铜屑为原料,回收制取纯铜。
查阅资料:Cu2(OH)2CO3+2H2SO4═2CuSO4+3H2O+CO2↑
Cu2(OH)2CO3![]() 2CuO+H2O+CO2↑
2CuO+H2O+CO2↑
如图是该兴趣小组设计的两种回收铜的实验方案:
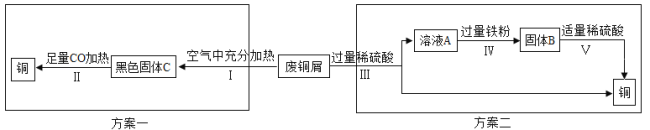
【分析评价】①步骤Ⅱ反应过程中发生了还原反应的物质是 (填化学式)。
②步骤Ⅲ、Ⅳ、Ⅴ都需要进行的实验操作是 。
③步骤Ⅴ过程发生反应的化学方程式为 。
④同一份废铜屑分别通过上述两种方案最终得到的铜的质量:方案一 (填“>”或“=”或“<”)方案二。以上两种方案中,方案二优越于方案一,理由是 (任答一点)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com