
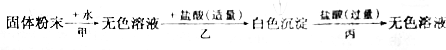
分析 根据氯化钡和硫酸铝会生成不溶于酸的硫酸钡沉淀,碳酸根离子和酸反应会生成二氧化碳气体,氢氧化铝有两性,既可与强酸反应生成盐和水,也可与强碱反应生成盐和水,向偏铝酸钠溶液中加入适量的盐酸又可生成氢氧化铝沉淀等知识进行分析.
解答 解:(1)氯化钡和硫酸铝会生成不溶于酸的硫酸钡沉淀,碳酸根离子和酸反应会生成二氧化碳气体,氢氧化铝有两性,既可与强酸反应生成盐和水,也可与强碱反应生成盐和水,向偏铝酸钠溶液中加入适量的盐酸又可生成氢氧化铝沉淀,固体粉末加水会得到无色溶液,无色溶液加入适量盐酸会生成白色沉淀,加入过量盐酸,沉淀溶解,所以混合物中不含氯化钡、碳酸钠,一定含有硫酸铝、氢氧化钠,可能含有氯化钠;
(2)甲:硫酸铝和氢氧化钠反应生成硫酸钠和氢氧化铝沉淀,氢氧化铝和氢氧化钠反应生成偏铝酸钠和水,化学方程式为:Al2(SO4)3+6NaOH=3Na2SO4+2Al(OH)3↓,Al(OH)3+NaOH═NaAlO2(偏铝酸钠)+2H2O;
乙:偏铝酸钠和盐酸反应生成氯化钠和氢氧化铝,化学方程式为:NaAlO2+H2O+HCl═NaCl+Al(OH)3↓;
丙:氢氧化铝和盐酸反应生成氯化铝和水,化学方程式为:Al(OH)3+3HCl=AlCl3+3H2O.
故答案为:(1)硫酸铝、氢氧化钠,碳酸钠、氯化钡,氯化钠;
(2)甲:Al2(SO4)3+6NaOH=3Na2SO4+2Al(OH)3↓,Al(OH)3+NaOH═NaAlO2(偏铝酸钠)+2H2O;
乙:NaAlO2+H2O+HCl═NaCl+Al(OH)3↓;
丙:Al(OH)3+3HCl=AlCl3+3H2O.
点评 在解此类题时,首先分析题中所给物质的性质和两两之间的反应,然后依据题中的现象判断各物质的存在性,最后进行验证即可.


科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 物质 | X | 氧气 | 水 | 二氧化碳 | 一氧化碳 |
| 反应前质量/g | 3.2 | 11.2 | 0 | 0 | 0 |
| 反应前质量/g | 0 | 0 | 7.2 | 4.4 | a |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验操作和步骤 | 实验现象 | 实验结论 |
| (1)各取少量四种溶液于4支试管中,分别滴加紫色石蕊试液 | 其中一支试管中紫色石蕊试液变红色 | 原溶液是盐酸溶液 |
| (2)另取少量未确定的三种溶液,分别滴加步骤(1)检出的溶液 | 一支试管中有气泡放出 | 原溶液是碳酸钠溶液 有关反应的化学方程式为 Na2CO3+2HCl═2NaCl+H2O+CO2↑ |
| (3)再取剩余的两种未知溶液于A、B两支试管中,滴加步骤(2)检出的溶液 | A试管中:出现白色沉淀 B试管中:无明显现象 | A是氢氧化钙溶液 B是氢氧化钠溶液 有关的化学方程式为: Na2CO3+Ca(OH)2═CaCO3↓+2NaOH |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com