
 碳酸氢钠常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的热稳定性进行探究.
碳酸氢钠常用于食品和医药工业.某化学兴趣小组的同学对碳酸氢钠的热稳定性进行探究.| 实验 | 实验现象 | 结论 |
| 实验一:取少量反应后的固体产物溶于水,滴入几滴酚酞试液 | 溶液变成红色 | 固体产物是NaOH,而不是Na2CO3 |
| 实验二:取少量反应后的固体产物溶于水,加入过量氯化钙溶液 | 固体产物是Na2CO3,而不是NaOH | |
| 实验三: |
产生大量气泡 | 固体产物是Na2CO3,而不是NaOH |
| ||
| 实验 | 实验现象 |
| 方案二: | 产生白色沉淀 |
| 方案三:取少量反应后的固体产物,加入过量稀盐酸(或稀硫酸、稀硝酸、醋酸) |
| ||


 期末集结号系列答案
期末集结号系列答案科目:初中化学 来源: 题型:
 (2011?黄石)碳酸氢钠常用于食品和医药工业、某化学兴趣小组对碳酸氢钠的热稳定性进行探究.
(2011?黄石)碳酸氢钠常用于食品和医药工业、某化学兴趣小组对碳酸氢钠的热稳定性进行探究.| 实验操作 | 预期实验现象 | 结论 |
| 取少量固体样品溶于水 | 没有放出热量 没有放出热量 |
猜想Ⅱ结论不正确 |
| 取少量固体样品于试管中,加入足量盐酸 | 有气泡冒出 有气泡冒出 |
猜想Ⅰ结论正确 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 碳酸氢钠常用于食品和医药工业,某化学兴趣小组对碳酸氢钠进行探究.
碳酸氢钠常用于食品和医药工业,某化学兴趣小组对碳酸氢钠进行探究.| 实验 | 实验现象 | 结论 |
| 实验一:取少量反应后的固体产物溶于水,滴入几滴酚酞试液 | 溶液变成红色 | 固体产物是NaOH,而不是Na2CO3 |
| 实验二:取少量反应后的固体产物溶于水,加入氯化钙溶液 | 产生白色沉淀 产生白色沉淀 |
固体产物是Na2CO3,而不是NaOH |
| 实验三: 取少量反应后的固体产物溶于水,加入稀盐酸(或稀硫酸) 取少量反应后的固体产物溶于水,加入稀盐酸(或稀硫酸) |
产生大量气泡 | 固体产物是Na2CO3,而不是NaOH |
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:
(6分)碳酸氢钠常用于食品和医药工业、某化学兴趣小组对碳酸氢钠的热稳定性
进行探究。
[查阅资料]碳酸氢钠受热易完全分解,生成水、二氧化碳气体和一种常见固体物质,该固体物质含有三种元素,且为纯净物。
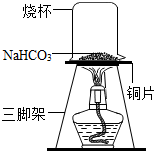
[进行实验一]为了验证碳酸氢钠受热时会分解,该兴趣小组的同学取一定质量的碳酸氢钠放到铜片上加热,如图1 6所示。

加热一段时间后,观察小烧杯内壁有_______________现象,证明有水生成;通过
_________证明有CO2生成。
[提出问题]碳酸氢钠充分加热后固体产物是什么?
[作出猜想]猜想Ⅰ:固体产物是Na2CO3
猜想Ⅱ:_____________________(请完成猜想Ⅱ)。
[进行实验二]下表是该兴趣小组同学设计的实验方案,用来检验碳酸氢钠分解后固体产物的成分。请你完成方案:

[拓展应用]碳酸氢钠常用来治疗胃酸过多,但对于患有胃溃疡(胃黏膜溃烂)的病人在胃 酸(可用盐酸表示)过多时,却不宜服用碳酸氢钠,其原因是_______________________(用化学方程式表示)。
查看答案和解析>>
科目:初中化学 来源:湖北省中考真题 题型:实验题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com