
【题目】如图是几种初中化学常见物质的转化关系的示意图(部分产物未标出),其中A、D均属于碳酸盐。回答下列问题:
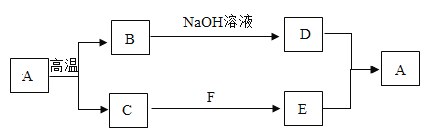
(1)写出下列物质的化学式:C_______,D____。
(2)写出D与E反应的化学方程式:_____。
科目:初中化学 来源: 题型:
【题目】选择下列部分实验操作可完成两个实验,甲实验为除去粗盐中难溶性的杂质,乙实验为配制溶质质量分数为10%的氯化钠溶液。下列说法正确的是( )
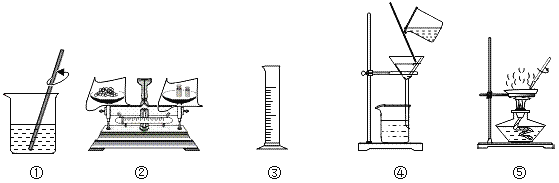
A. 操作①和⑤中玻璃棒的作用是相同的
B. 甲实验和乙实验都要用到的实验操作①
C. 甲实验在操作⑤时,将水全部蒸发后停止加热
D. 乙实验在操作③时,若俯视读数,会使所配制溶液的溶质质量分数偏小
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】25℃时,探究某固体物质的溶解性,实验记录如下表。下列实验结论正确的是
编号 | ① | ② | ③ | ④ |
水的质量/g | 50 | 50 | 50 | 50 |
加入固体质量/g | 5 | 10 | 15 | 20 |
现象 | 固体完全溶解 | 固体完全溶解 | 剩余少量固体 | 剩余较多固体 |
A.实验①所得溶液的溶质质量分数是实验②的一半
B.在实验④中再加入 50g水后,溶液的溶质质量分数为 15%
C.由表格中的数据可以确定 25℃时该物质的溶解度大小的范围是:20 g≤S<30g
D.实验②中温度由 25℃冷却到 10℃时,一定有固体析出
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图是a、b、c三种固体物质(不含结晶水)的溶解度曲线。下列叙述正确的是( )
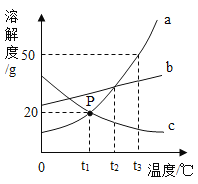
A. t1℃时,a、c两种物质饱和溶液的溶质质量分数为20%
B. 将接近饱和的c物质的溶液变成饱和溶液,可采用加溶质、降温等方法
C. 将a、b、c三种物质的饱和溶液从t2℃降温至t1℃,所得溶液中溶质质量分数的大小关系为b>a=c
D. 将150g a物质的饱和溶液从t3℃降温至t1℃,可析出30g a物质
查看答案和解析>>
科目:初中化学 来源: 题型:
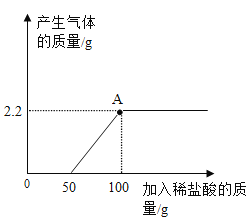
【题目】向部分变质的NaOH溶液中逐滴滴加稀盐酸,产生气体质量与所加稀盐酸质量关系如图所示:
(1)完全反应后,产生气体的质量是__g。
(2)当滴加稀盐酸至图中A点时,溶液中含有的溶质是__。
(3)所加稀盐酸中溶质的质量分数是____。(写出规范的计算过程)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列关于化学学科基本观念的认识,错误的是( )
A.元素观:金刚石、石墨、C60都是由碳元素组成的单质
B.转化观:氧化铁在一定条件下可以转化为金属铁
C.微粒观:保持氧气化学性质的最小微粒是氧分子
D.守恒观:18g氢气和18g氧气充分反应可生成36g水
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】碳酸锂是一种重要的锂盐,广泛应用于锂离子电池生产中。工业上可以用锂辉石精矿(主要成分是Li2O、含有Al2O3、SiO2等杂质) 为原料制取高纯的碳酸锂。某校化学活动小组收集了碳酸锂的溶解度数据如表:
温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 |
溶解度(g) | 1.54 | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
设计了制取碳酸锂的工艺流程(如图):
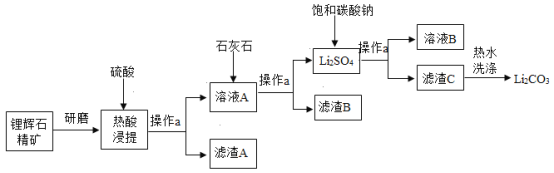
请回答:
(1)操作a所需的玻璃仪器有烧杯、玻璃棒和_____。
(2)热酸浸提中可能发生反应的化学方程式:
①_____;
②Li2O+H2SO4=Li2SO4+H2O。
(3)“洗涤”滤渣C时应该使用热水,其原因是_____。
(4)为了探究热酸浸提的最佳条件,将矿石在一定条件下酸浸4小时,测量锂元素浸出率的部分数据如表:
编号 | 矿酸比 | 硫酸浓度(%) | MgSO4用量(g) | 温度(℃) | 锂元素浸出率(%) |
1 | 1:1 | 90 | 0.00 | 100 | 70.34 |
2 | 1:1 | 98 | 0.00 | 100 | 73.89 |
3 | 1:1 | 98 | 0.00 | 150 | 78.24 |
4 | 1:3 | 98 | 0.00 | 200 | 85.53 |
5 | 1:3 | 98 | 1.25 | 250 | 90.26 |
6 | 1:3 | 98 | 2.50 | 250 | 95.88 |
①对比分析编号1和编号2的实验数据,可以得到的结论是_____。
②有同学想在实验6的基础上,从降低成本角度继续研究提高锂元素的浸出率,下面设计合理的是_____。
A 矿酸比1:2,硫酸浓度98%,MgSO4用量0.00,温度150℃
B 矿酸比1:2,硫酸浓度98%,MgSO4用量2.50,温度200℃
C 矿酸比1:2,硫酸浓度98%,MgSO4用量2.50,温度250℃
D 矿酸比1:3,硫酸浓度98%,MgSO4用量2.00,温度250℃
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】为及时发现燃气泄漏,常在燃气中加入少量有特殊气味的乙硫醇(C2H5SH),乙硫醇燃烧的化学方程式为2C2H5SH+9O2![]() 4CO2+2X+6H2O。下列关于X的说法正确的是
4CO2+2X+6H2O。下列关于X的说法正确的是
A.X的化学式是SO3
B.X中氧元素的质量分数为50%
C.X由碳、硫、氧三种元素组成
D.X中硫元素与氧元素的质量比为1:2
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】有A、B、C、D四种元素,A元素是人体中含量最多的元素,B元素形成的单质是空气中含量较多且化学性质不活泼的气体,C2+的核外有两个电子层,D元素是人体必需的一种微量元素,如缺少将导致贫血。试回答:
(1)A元素的名称是:_____。
(2)B元素形成的单质的化学式:_____。
(3)D元素的单质在氧气中燃烧的化学方程式为:_____。
(4)A、B、C三种元素组成的化合物的化学式:_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com