
 第一:有氧气生成;第二:
第一:有氧气生成;第二:


科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
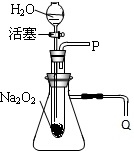
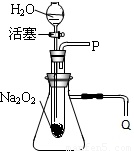
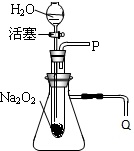 化学课上老师做了一个演示实验:用脱脂棉包住约0.2g过氧化纳(Na202)粉末,置于石棉网上,往脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来.
化学课上老师做了一个演示实验:用脱脂棉包住约0.2g过氧化纳(Na202)粉末,置于石棉网上,往脱脂棉上滴水,观察到脱脂棉剧烈燃烧起来.
查看答案和解析>>
科目:初中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:初中化学 来源:2011年第二十一届“天原杯”全国初中学生化学素质和实验能力竞赛(江西赛区)初赛试卷(解析版) 题型:填空题
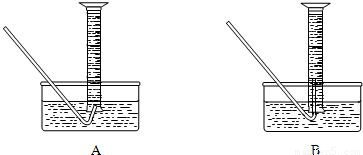
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com