
下图所示的实验中,反应前氧化铁和碳粉的质量分别为32克和1.2克,反应后得到气体A和28.8克黑色固体B。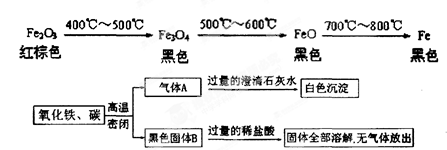
(1)白色沉淀的质量为 g;
(2)推断黑色固体B的化学式。(要求写出推断过程)
(1) 10g (2) FeO
解析试题分析:(1)根据反应过程中的现象,在黑色固体B中加过量的稀盐酸,固体全部溶解,且无气体放出,说明:1、没有碳剩余,2、没有铁生成;根据1,可以这样推断反应前1.2g碳,经过变为二氧化碳,最终变为碳酸钙中的碳,所以可设碳酸钙质量为x
X×12/100×100% = 1.2g
∴x=10
(2)根据上面分析没有铁生成,那么就只有可能两种生成物Fe3O4、FeO
① 假设生成Fe3O4,那方程式为:C+6Fe2O3 4Fe3O4+CO2,可设32克氧化铁要完全反应需要的碳粉质量为x
4Fe3O4+CO2,可设32克氧化铁要完全反应需要的碳粉质量为x
C + 6Fe2O3 4Fe3O4+CO2
4Fe3O4+CO2
12 960
x 32克
12:960 = x:32克
∴ x=0.4克<1.2克 故不是按这个反应进行
②假设生成FeO,那方程式:C+2Fe2O3 4FeO+CO2,可设32克氧化铁要完全反应需要的碳粉质量为y
4FeO+CO2,可设32克氧化铁要完全反应需要的碳粉质量为y
C + 2Fe2O3 4FeO+CO2
4FeO+CO2
12 320
Y 32克
12:320 = y:32克 ∴y=1.2克=1.2克 所以是按这个反应进行,故黑色固体B的化学式FeO
考点:根据化学方程式进行的计算


科目:初中化学 来源: 题型:计算题
为测定某BaCl2溶液的溶质质量分数,现取100gBaCl2溶液,不断加入稀H2SO4,反应过程中溶液质量与加入稀H2SO4的质量关系如图所示,(反应方程式:BaCl2+H2SO4=BaSO4↓+2HCl)请回答: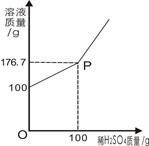
(1)P点意义_______________。
(2)反应生成BaSO4沉淀的质量为_________g。
(3)求原BaCl2溶液的溶质质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
过氧化氢溶液长期保存会自然分解,使溶液的溶质质量分数减小。小军从家中拿来一瓶久置的医用过氧化氢溶液,和同学们一起测定其溶质质量分数,他们取该溶液51 g,加入适量二氧化锰,生成氧气的质量与反应时间的关系如图所示。则: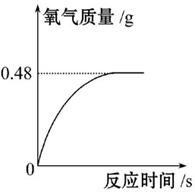
(1)完全反应后生成氧气的质量为 。
(2)计算该过氧化氢溶液中溶质的质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
黄铜是铜、锌合金,它可用来制造机器、电器零件及日用品。为测定某黄铜样品中铜的质量分数,现取10 g该样品粉碎,加入到50 g稀硫酸中,恰好完全反应,测得剩余固体质量为3.5 g。计算:
(1)黄铜样品中铜的质量分数。
(2)稀硫酸中溶质的质量分数。
(3)由此得到启示是:在使用黄铜制品时应注意 。(合理即可)
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
我国早在春秋战国时期,就开始生产和使用铁器。某化学小组到钢铁厂做社会调查,将不同质量的生铁样品(假定其中只含铁和碳两种单质)分别放入5只烧杯中,各加入189.2 g质量分数相同的稀硫酸进行实验,实验数据见下表:
| | 烧杯① | 烧杯② | 烧杯③ | 烧杯④ | 烧杯⑤ |
| 加入生铁样品 的质量/g | 3.0 | 6.0 | 9.0 | 12.4 | 14.0 |
| 充分反应后 生成气体 的质量/g | 0.1 | M | 0.3 | 0.4 | 0.4 |
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
某化工厂排放的废水中含有一定量的氢氧化钾,为了回收利用,欲用2%的稀盐酸测定废水中的氢氧化钾含量(废水中其他杂质不与盐酸反应)。
试计算:
(1)用10克30%的浓盐酸配制成2%的稀盐酸,需加水多少克?
(2)取20克废水于锥形瓶中,逐滴加入2%的稀盐酸,至恰好完全反应时,消耗稀盐酸7.3克,求废水中氢氧化钾的质量分数。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
氢化锂(LiH)为玻璃状无色透明固体,军事上用作氢气发生来源,反应的化学方程式为:LiH + H2O="LiOH" + H2↑。计算80 g氢化锂与足量的水反应生成氢气的质量。
查看答案和解析>>
科目:初中化学 来源: 题型:计算题
为测定某氯化钠溶液中溶质的质量分数,做如下实验:向烧杯中加入10克该氯化钠溶液,然后向其中加入AgNO3溶液,发生复分解反应生成AgCl沉淀.滴加硝酸银溶液质量与产生沉淀质量关系如图所示.根据实验计算,该氯化钠溶液中溶质的质量分数是多少?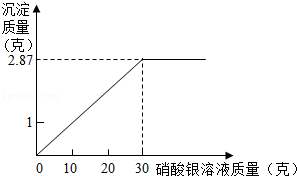
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com