
 人的胃液里含有适量的盐酸,可帮助消化,但如果分泌过多,人会感到胃痛.小军拿来了一种治疗胃酸过多的药物,该药物说明书的部分内容如图所示.
人的胃液里含有适量的盐酸,可帮助消化,但如果分泌过多,人会感到胃痛.小军拿来了一种治疗胃酸过多的药物,该药物说明书的部分内容如图所示. =
=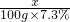
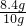 ×100%=84%.
×100%=84%.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:阅读理解
 17、人的胃液里含有适量的盐酸,可以帮助消化,但如果胃酸分泌过多,人会感到胃痛.小军拿来了一种抗酸药(治疗胃酸过多的药物),该药物说明书的部分内容如图所示.当小军看到药物说明书上的服用方法后,对此产生了探究的兴趣,请你和他一起完成探究活动.
17、人的胃液里含有适量的盐酸,可以帮助消化,但如果胃酸分泌过多,人会感到胃痛.小军拿来了一种抗酸药(治疗胃酸过多的药物),该药物说明书的部分内容如图所示.当小军看到药物说明书上的服用方法后,对此产生了探究的兴趣,请你和他一起完成探究活动.查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 16、人的胃液里含有适量的盐酸,可以帮助消化,
16、人的胃液里含有适量的盐酸,可以帮助消化,查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源:河北省中考真题 题型:实验题

查看答案和解析>>
科目:初中化学 来源:2013年广东省揭阳市揭西县钱坑中学九年级化学竞赛试卷(解析版) 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com