
分析 【交流表达】(2)根据实验现象和氯化钙、氯化镁、氯化铁、氯化钠性质进行分析解答;
【含量计算】根据固体的成分是碳酸钙,可求出原样品中氯化钙的质量;
(3)该问题是探究氯化钾中所含杂质的成分,并得到纯度较高的氯化钾,根据提纯原则解释;
(4)根据生成物质的溶解性作出判断.
解答 解:(2)由实验①得到无色澄清溶液,可知该粉末中一定不含氯化铁,因为氯化铁溶液为黄色;
该粉末中一定含有氯化镁,则加入过量的氢氧化钾溶液,出现白色浑浊,需要过滤,所以实验②要用到的玻璃仪器有烧杯、玻璃棒、滴管和漏斗;
由实验③滤液中加入稍过量的碳酸钾溶液,出现白色沉淀可知该粉末中一定含有氯化钙;因为 CaCl2+Na2CO3═CaCO3↓+2NaCl;
若向实验③所得滤液中滴加无色酚酞溶液,溶液变成红色,说明了碳酸钾溶液滴加已经过量,因为碳酸钾溶液显碱性;
【含量计算】设原样品中氯化钙的质量为x
CaCl2+K2CO3═CaCO3↓+2KCl
111 100
x 4g
$\frac{111}{x}=\frac{100}{4g}$
解得x=4.44g
所以求原样品中氯化钙4.44g.
(3)该问题是探究氯化钾中所含杂质的成分,并得到纯度较高的氯化钾,如果氢氧化钾溶液和碳酸钾溶液可以改为氢氧化钠溶液和碳酸钠溶液会混入新杂质钠离子,故不可行;
(4有同学认为由实验②不能说明一定含有氯化镁,原因是氯化钙与氢氧化钾反应产生的氢氧化钙微溶于水.
故答案为:(2)氯化铁;漏斗;氯化钙;CaCl2+K2CO3═CaCO3↓+2KCl;碳酸钾溶液显碱性
【含量计算】4.44g;
(3)不可行;
(4)氯化钙与氢氧化钾反应产生的氢氧化钙微溶于水.
点评 本题属于分离混合物及除杂问题的考查,采用的是化学转化法,在做物质的除杂题时,要搞清除需要除去的离子,在选择适当的试剂将其沉淀,当加入的试剂的状态和杂质状态相同时,要注意加入量的控制.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:解答题
| 反应时间t∕s | t0 | t1 | t2 | t3 | t4 |
| 反应后固体的质量m∕g | 6 | 4.24 | 4.16 | 4.08 | 4.08 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
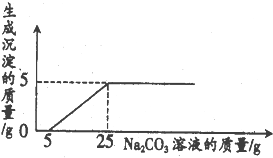 实验室废液桶中收集到大量含有盐酸与氯化钙的废液,取100g废液向其中慢慢滴加溶质质量分数为26.5%的Na2CO3溶液,加人Na2CO3溶液的质量与生成沉淀的质量关系如下图所示.请计算回答下列问题:
实验室废液桶中收集到大量含有盐酸与氯化钙的废液,取100g废液向其中慢慢滴加溶质质量分数为26.5%的Na2CO3溶液,加人Na2CO3溶液的质量与生成沉淀的质量关系如下图所示.请计算回答下列问题:查看答案和解析>>
科目:初中化学 来源: 题型:选择题
 2015年10月,屠呦呦因发现青蒿素治疗疟疾的新疗法获诺贝尔生理学或医学奖.关于青蒿素(化学式为Cl5H22O5)的说法正确的是( )
2015年10月,屠呦呦因发现青蒿素治疗疟疾的新疗法获诺贝尔生理学或医学奖.关于青蒿素(化学式为Cl5H22O5)的说法正确的是( )| A. | 青蒿素由C、H、O三种原子构成 | |
| B. | 28.2g青蒿素中含碳元素的质量为18g | |
| C. | 一个青蒿素分子含有11个氢分子 | |
| D. | C、H、0三种元素的质量比为15:22:5 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 选项 | 物质 | 杂质 | 操作方法 |
| A | 氮气 | 氢气 | 点燃 |
| B | 水 | 臭味物质 | 加适量的明矾吸附、过滤 |
| C | 二氧化锰 | 木炭粉 | 在空气中灼烧 |
| D | 白糖 | 食盐 | 加水溶解后过滤 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
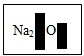
| 实验操作 | 实验现象 |
| 取少量样品于试管中,慢慢滴加一种溶液,静置一段时间,滤去上层清液,向沉淀中继续滴加稀盐酸 | 先出现白色沉淀,后产生大量气泡 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com