在实验考试前夕,小毛同学在实验操作练习中,发现盛放氢氧化钠溶液的试剂瓶瓶口有白色粉末.为了确定白色粉末的成分,小毛进行了如下的探究:
(1)小毛猜测白色粉末中含有碳酸钠,请指出他的理由:______(用化学方程式表示).
(2)为了确定自己的猜测,小毛设计了如下的方案:取少量白色粉末于试管中,加水溶解配成溶液,再用酚酞溶液检验.你认为他的方案可行吗?为什么?______
(3)如果你是小毛的同桌,请你设计另一种方案帮助小毛确定他的猜测.写出实验步骤、现象和结论,并写出相关的反应化学方程式.(不允许用步骤(4)的方法)______
(4)为了进一步确定白色粉末中碳酸钠的质量分数,小毛取了2g白色粉末,加入足量的水充分溶解,再滴加澄清石灰水,充分反应后,过滤,得到了白色沉淀1g.
①在过滤时,需用到玻璃棒,它的作用是______;除此之外,还需用到的玻璃仪器有______.
②请你帮小毛计算:白色粉末中碳酸钠的质量分数.
解:(1)氢氧化钠潮解后会与空气中的二氧化碳反应生成碳酸钠和水,故答案为:CO
2+2NaOH=Na
2CO
3+H
2O;
(2)显碱性的液体都会使酚酞变红色,氢氧化钠显碱性,碳酸钠是强碱弱酸盐,也显碱性,故答案为:不可行.因为氢氧化钠溶液和碳酸钠溶液都呈碱性;
(3)碳酸钠会与是盐酸反应生成二氧化碳气体,故答案为:取少量白色粉末于试管中,滴加稀盐酸,有气泡产生,证明白色粉末中含有碳酸钠;
碳酸钠和盐酸反应生成氯化钠、水和二氧化碳,故答案为:Na
2CO
3+2HCl═2NaCl+H
2O+CO
2↑;
(4)①过滤时需要有过滤器,和盛放液体的装置,玻璃棒的作用是引流,防止液体外溅,故答案为:引流; 漏斗和烧杯;
②先根据题中的叙述写出方程式,然后列出比例式解出碳酸钠的质量,最后求出碳酸钠的质量分数;
设白色粉末中碳酸钠的质量为X.
Na
2CO
3+Ca(OH)
2=CaCO
3↓+2NaOH
106 100
x 1g

=

x=1.06g
白色粉末中碳酸钠的质量分数为:
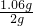
×100%=53%
答:白色粉末中碳酸钠的质量分数为53%.
分析:(1)根据氢氧化钠极易潮解,潮解后会与二氧化碳反应进行分析;
(2)根据酸碱指示剂遇到酸性或碱性液体的显色进行分析;
(3)根据碳酸根离子会与酸反应生成二氧化碳气体进行分析;
(4)①根据过滤操作中需要的仪器和玻璃棒的作用进行分析;
②根据题中的叙述列出方程式,然后根据比例关系解出碳酸钠的质量,在求解质量分数.
点评:在解此类题时,首先分析题意和题中考查的问题,然后结合学过的知识和题中所给的知识进行分析解答.

 =
=
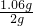 ×100%=53%
×100%=53%
