解:(1)根据在原子中,质子数=核外电子数,由原子结构示意图可知镓元素原子的质子数为:31;
原子核外有4个电子层;最外层电子数为:3;
(2)根据物质的色、味、态、熔、沸点、密度、硬度、水溶性等属于物理性质,从题中可知
镓的物理性质为:镓是银白色金属,密度为5.94g?cm
-3;
根据镓能与沸水剧烈反应生成氢气和氢氧化镓反应化学方程式为:2Ga+6H
2O

2Ga(OH)
3+3H
2↑;
根据目前金属镓广泛用于制造半导体材料,可知镓的用途为:制造半导体材料;
(3)由于镓化合价为+3,硫酸根的根价为-2,利用十字交叉法,则其化学式为:Ga
2(SO
4)
3;
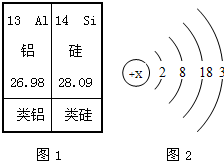
(4)从上述周期表片断中查出铝元素的一种数据:13为铝元素的原子序数.
故答案为:(1)31,4,3,失去,
(2)银白色金属,密度为5.94g?cm
-3; 2Ga+6H
2O

2Ga(OH)
3+3H
2↑; 制造半导体材料;
(3)Ga
2(SO
4)
3;(4)13为铝元素的原子序数.
分析:(1)根据在原子中,质子数=核外电子数,进行解答;离原子核最远的是最外层,依据原子结构示意图即可解答;
(2)物质的色、味、态、熔、沸点、密度、硬度、水溶性等属于物理性质;物质的化学性质包括可燃性、氧化性、还原性、稳定性、酸性、碱性、热解性等,通常描述的语句中有能、可以、可等字眼儿进行解答;
(3)由于镓常见化合价为+3,硫酸根的根价为-2,利用十字交叉法即可写出化学式.
(4)从上述周期表片断中查出铝元素的原子序数.
点评:本题考查学生根据题中所给的信息及所学知识进行分析解题的能力,注意书写化学方程式的写配标等.

 阅读材料,回答问题:
阅读材料,回答问题: 2Ga(OH)3+3H2↑;
2Ga(OH)3+3H2↑; 2Ga(OH)3+3H2↑; 制造半导体材料;
2Ga(OH)3+3H2↑; 制造半导体材料;

 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案 阅读材料,回答问题:
阅读材料,回答问题: