
【题目】将含有可溶性杂质的某氯化钠样品1.5g溶于足量水中得到不饱和溶液,再向所得溶液中小心滴入100g一定溶质质量分数的AgNO3溶液(杂质不与AgNO3溶液反应)。实验过程中,生成沉淀的质量与滴入AgNO3溶液的质量关系如图所示。试计算:
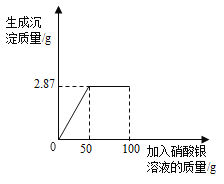
(1)加入100 g硝酸银溶液时,反应后溶液中溶质有_______________。
(2)原硝酸银溶液中溶质质量分数是多少__________?
科目:初中化学 来源: 题型:
【题目】芯片是电脑、智能家电的核心部件,它是以高纯度的单质硅(Si)为材料制成的。硅及其氧化物能发生如下反应,下列说法不正确的是( )
①Si+O2![]() SiO2
SiO2
②SiO2+Na2CO3![]() Na2SiO3+CO2↑
Na2SiO3+CO2↑
③SiO2+2C![]() Si+2CO↑
Si+2CO↑
④Si+2NaOH+H2O![]() Na2SiO3+2H2↑
Na2SiO3+2H2↑
A.属于置换反应的是反应③
B.硅原子和碳原子的化学性质相似是因为它们的最外层电子数相同
C.④反应中没有体现初中所学的碱的通性
D.上述四个反应中Si元素的化合价均发生了改变
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图表示一定质量的KClO3和MnO2固体混合物受热过程中,某变量随时间的变化趋势,纵坐标y可以表示( )
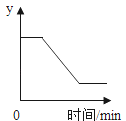
A.固体中氧元素的质量B.固体中MnO2的质量
C.生成O2的质量D.固体中钾元素的质量分数
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】请结合下图中A~F所示的实验,回答下列问题:
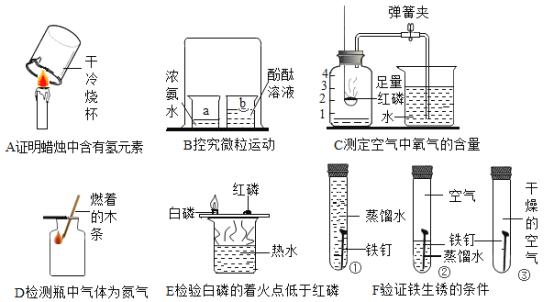
(1)实验B中,利用了氨水的性质有_______________。
(2) 导致实验C测定结果偏小的因素有_______________ (任写一条) 。
(3)实验D_______________(填“能”或“不能”)达到实验目的。
(4)实验E中发生反应的化学方程式为_______________。
(5)实验F得出“水是铁生锈条件之一”这一结论,依据的实验现象是____________。
(6)将实验A中干冷烧杯内壁涂上澄清石灰水后,能否证明石蜡中含有碳元素,为什么?_______________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】我国古代的物质文明华夏民族在认识、改造和应用物质方面有着辉煌的历史。
①东晋《抱扑子》中记载:“以曾青涂铁,铁赤色如铜”(“曾青”即硫酸铜溶液)。
②元代《庚道集》中记载:“点铜成银”(即单质铜与砷熔合形成银白色的合金)。
请运用你学过的化学知识回答下列问题:
(1)①中发生变化的化学方程式为_____________;②中的“银”与纯铜相比,物理特性的变化是______________________________。
(2)兰州中山铁桥历尽沧桑,百年不倒。工程师发现大桥铆合处簇新如初,说明百年来铆合处铁没有与_________反应而造成锈蚀。
(3)金属矿物储量有限,而且不能再生,保护金属资源的有效途径除防止金属的锈蚀,还有_________(写一条即可)等。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某工业废水含有大量FeSO4,少量Ag+及污泥。某同学设计了以下流程回收Ag和FeSO47H2O晶体。

(1)FeSO4中S的化合价为_____,2个银原子用化学符号表示为_____。
(2)步骤①中,经过滤得到污泥和溶液1.过滤需要的玻璃仪器有_____、_____和玻璃棒,玻璃棒的作用是_____。
(3)步骤②中:需加入的物质是_____,分离所得混合物的方法是_____。
(4)步骤③中:需加入的物质是_____,发生反应的化学方程式是_____。
(5)某同学认为经过步骤②后所得固体就是纯净的银,不需要进行步骤③,你认为是否合理?_____,理由是_____。
(6)溶液2和溶液3合并的目的是_____、_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某种矿石由氧化镁、氧化铁、氧化铜和二氧化硅组成,用它制备氢氧化镁的流程示意图如图所示(已知:二氧化硅不溶于水也不与稀盐酸反应)。
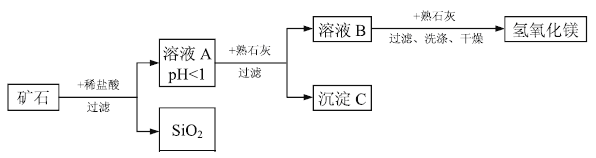
请回答下列问题:
(1)溶液A中共含有____种阳离子;写出矿石中的任意一种金属氧化物与稀盐酸反应的化学方程式:____________(只写一个)。
(2)在溶液A中加入熟石灰调节溶液的pH,可以使溶液中的金属阳离子逐步转化为沉淀。该实验条件下,使金属阳离子沉淀的相关pH数据见下表。为保证产品纯度、减少产品损失,并便于操作,所得溶液B的pH的取值范围为________。
氢氧化物 | Fe(OH)3 | Cu(OH)2 | Mg(OH)2 |
开始沉淀的pH | 1.5 | 4.2 | 8.6 |
完全沉淀的pH | 3.2 | 6.7 | 11.1 |
(3)写出溶液B中加入熟石灰发生的化学反应方程式:___________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某化学活动小组以“酸、碱、盐的性质”为主题进行探究性学习,请你与他们一起解决下列问题。
(1)下面是该组同学在探究酸、碱、盐的性质时对某无色溶液所含溶质的记录,其中合理的是_____(填字母代号)。
a.氢氧化钠、碳酸钠、氯化钠
b.硝酸钾、氯化钠、氯化铁
c.氢氧化钙、碳酸钠、氯化钠
d.氢氧化钠、氯化钠、氯化氢
(2)我国化学家侯德榜发明了联合制碱法,所制得的“碱”的化学式是_____。
(3)通过查阅资料可知,过氧化钠固体(Na2O2)与水反应生成氢氧化钠和氧气,写出该反应的化学方程式_____。
(4)在学习NaOH性质时知道,氢氧化钠溶液久置在空气中易变质,如图是敞口放置的氢氧化钠溶液,康康同学想知道该溶液是否变质或变质的程度。
①写出氢氧化钠变质的原因。_____(用文字描述)
②请设计实验验证该溶液的成分。_____(简要写出实验步骤、现象和结论)
③如何除去少量变质的NaOH溶液中的杂质,用化学方程式表示_____。
(5)取部分变质的氢氧化钠溶液50g,向其中加入溶质质量分数为9.8%的稀硫酸50g.恰好完全反应得到中性溶液,计算反应后溶液中溶质的质量_____。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】硝酸钾、氯化钠两种物质的溶解度曲线如图所示。
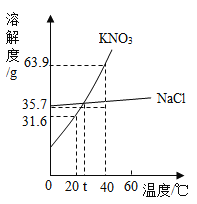
(1)20℃时,将 35g 的硝酸钾加入 100g 的水中充分溶解后所得溶液_______(填“是”或“否”)达到饱和。
(2)从海水中得到食盐晶体,采用的结晶方法是____________
(3)将 40℃的硝酸钾饱和溶液 163.9g 降温至 20℃,可析出晶体____________ g。
(4)t℃硝酸钾与氯化钠的溶解度相等(20℃氯化钠溶 解度为 36g)。以下计算结果最接近 t℃时硝酸钾饱和溶液的溶质质量分数是_________(填序号)。
A ![]() B
B ![]() C
C ![]() D
D ![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com