某化学研究性学习小组参加社会实践调查得知:某化工厂为综合利用生产过程中的副产品CaSO
4,与相邻的化肥厂联合设计了图1制备(NH
4)
2SO
4 的工艺流程.
上述流程中,沉淀池中发生的主要化学反应为CO
2+2NH
3+CaSO
4+H
2O=CaCO
3↓+(NH
4)
2SO
4
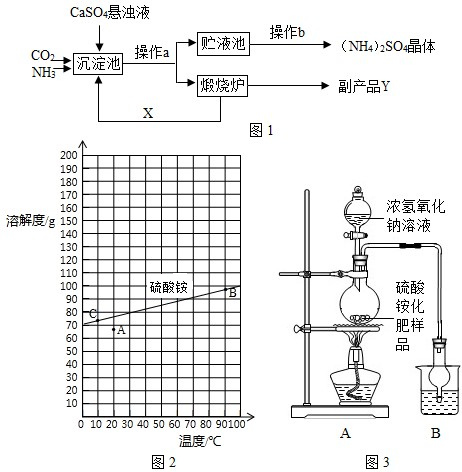
【讨论交流】
(1)操作a的名称是
过滤
过滤
,实验室中进行此操作时,用到的玻璃仪器除玻璃棒、烧杯外,还需要
漏斗
漏斗
.
(2)经操作a后得到的某物质在煅烧炉中发生反应的化学方程式为
.该工艺中,X在沉淀池中被消耗,在煅烧炉中又生成,故X可循环使用.X的填化学式为
CO2
CO2
.
(3)图中操作b应怎样进行呢?
查阅资料:图2是硫酸铵在水中的溶解度曲线.
表:固体硫酸铵在部分温度时的溶解度.
| 温度/℃ |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
100 |
| 溶解度/g |
70.6 |
73 |
75.4 |
78 |
81 |
85 |
88 |
? |
95 |
98 |
103 |
下列说法正确的有
①②③④
①②③④
.
①从溶解度曲线中,可以查找70℃时硫酸铵的溶解度约90g;
②图中的A点表示硫酸铵溶液的状态不饱和
③若将A点变成B点的操作采用加热蒸发,使溶液浓缩的方法
④若将B点转化为C点时,采用的是冷却热饱和溶液方法
【拓展研究】该化肥厂生产的硫酸铵化肥品质怎样呢?
【查阅资料】下表是硫酸铵化肥品质的主要指标.
指标
项目 |
优等品 |
一等品 |
合格品 |
| 外观 |
白色结晶,
无可见机械杂质 |
无可见机械杂质 |
| 氮(N)含量 |
≥21.0% |
≥21.0% |
≥20.5% |
氨气极易溶于水,其水溶液为氨水,呈碱性.
已知:(NH
4)
2SO
4+2NaOH═Na
2SO
4+2NH
3↑+2H
2O
【观察外形】该硫酸铵化肥无可见机械杂质.
【试验探究】按图3所示装置进行实验)
(1)实验过程中,为使硫酸铵充分反应完全转化为NH
3,则需往烧瓶中加入足量浓氢氧化钠溶液并充分加热.
(2)烧杯中盛放的试剂稀硫酸可以吸收氨气,两者化合生成一种
盐,写出化学方程式
2NH3+H2SO4=(NH4)2SO4
2NH3+H2SO4=(NH4)2SO4
.
【定量研究】取68g硫酸铵化肥样品于烧瓶中,等充分反应后,盛放稀硫酸的烧杯中增重17g,通过计算推知硫酸铵化肥品质指标为
合格
合格
(实验误差忽略不计)请列出计算过程.
【交流讨论】甲同学认为:应在实验装置A、B之间加装一个干燥装置,否则根据实验测得的数据,计算硫酸铵化肥的含氮量可能
偏高
偏高
(填“偏高”或“偏低”).



 优生乐园系列答案
优生乐园系列答案
