
【题目】向盛有100g稀硫酸的烧杯中加入一定量的镁粉,固体完全溶解后,再向所得溶液中加入NaOH溶液,所得沉淀质量与加入NaOH溶液的质量关系如下图所示:

(1)已知2NaOH+MgSO4=Mg(OH)2↓+Na2SO4 ,计算氢氧化钠溶液的溶质质量分数;
(2)求与氢氧化钠溶液反应所消耗硫酸溶质的质量。
科目:初中化学 来源: 题型:
【题目】铜及其化合物在生产、生活中都有广泛的应用。
一、铜的性质及其应用
兔首和鼠首均为青铜器(铜、锡合金),表面呈绿色,这是铜器长期暴露在空气中生成了铜锈(铜锈俗称铜绿)。铜绿化学式是Cu2(OH)2CO3,它受热会分解生成三种氧化物。
(1)青铜器属于______(填序号)。
A.无机材料 B.合成材料 C.复合材料 D.复合肥
(2)铜绿分解的化学方程式为_____________________。
(3)为了弄清铜生成铜绿的条件,某化学实验小组借鉴课本“铁钉锈蚀条件的探究”实验,设计了“铜片锈蚀条件的探究”实验,实验如下图所示(所用铜片洁净、光亮,试管内的“![]() ”为铜片)。
”为铜片)。

实验较长时间后,发现_____(填试管编号)试管中铜片最先生锈。小组讨论后发现实验还不够完善,要得出正确的结论,还要补充一个实验。你认为要补充的一个实验是:Cu和______(写出试管中需要的物质)。可以省略不做的实验是试管______(填试管编号)。
二、铜的制备研究
铜可采用如下方法制备:
方法一:火法炼铜:Cu2S+O2![]() 2Cu+SO2
2Cu+SO2
方法二:湿法炼铜:CuSO4+Fe=FeSO4+Cu
(4)上述两种方法中,你认为哪种方法更好________,原因是__________(写出1条原因即可)。辉铜矿的主要成分为Cu2S,常用于火法炼铜。若生成过程中铜元素的转化率为90%,生产64tCu需要含Cu2S80%的辉铜矿_____t(取整数)。
三、铜的化合物的制备研究
碱式碳酸铜可用于生产木材防腐剂等。工业上可用微蚀刻废液(含有一定量Cu2+、H+、SO42-、H2O2和微量Fe3+)制备高纯度碱式碳酸铜,其制备过程如下:

(5)加入试剂1的目的是除去废液中的酸性物质,试剂1最好选用______(填序号)。
a.Fe2O3 b. CaCO3 c.CuO
(6)加入Na2CO3沉淀前须除去Fe3+,否则Fe2(SO4)3会与Na2CO3反应,产生一种气体,同时生成NaFe3(OH)6(SO4)2沉淀,影响产品质量,6Na2CO3+3Fe2(SO4)3+6H2O=2NaFe3(OH)6(SO4)2+6CO2↑+5____ 。
(7)加入Na2CO3沉淀时,反应液pH对产品中的SO42- 含量以及反应液中Cu2+沉淀效率的影响如下图所示,第二次沉淀时溶液pH最好控制在_________。

(8)所制得的碱式碳酸铜的组成可表示为:xCuCO3·yCu(OH)2·zH2O。某研究小组设计如右上图实验装置测定其中CuCO3的质量分数(不考虑植物油中溶解CO2产生的影响)。
实验步骤如下:①连接装置并_______;②准确称量样品的质量1.2g;③装药品,调节量气装置两边液面相平,读取量气管刻度为10ml;④向锥形瓶内加入50ml(足量)的稀硫酸,充分反应;⑤冷却到室温;⑥再次调节量气装置两边液面相平,读取量气管刻度为172ml。
Ⅰ.请将上述实验步骤补充完整;
Ⅱ.装置B的作用是____,少量植物油的作用是______,C中的试剂是_____(填字母序号);
a.碱石灰 b.浓硫酸 c.无水硫酸铜
Ⅲ.步骤⑥中调节液面相平的操作是将水准管_____(填“缓慢上移”或“缓慢下移”)。
Ⅳ.若标准状况下,每44g二氧化碳的体积为22.4L。根据实验数据计算产品中CuCO3的质量分数(写出计算过程)_________。(保留到0.1%)
Ⅴ.若其他操作均正确,仅因下列因素可使测定结果偏小的是______(填字母序号);
A.步骤③中平视刻度,步骤⑥中仰视读数
B.硫酸的用量不足
C.量气管中未加植物油
D.步骤⑥中没有调节量气装置两边液面相平,直接读数
(9)碱式碳酸铜【xCuCO3·yCu(OH)2·zH2O】的热分解研究。小组同学用热分析仪对固体进行热分解,获得相关数据,绘成的固体质量与分解温度的关系如下图。

(已知Cu(OH)2的分解温度小于CuCO3的分解温度。)
Ⅰ.通过计算可得x:y:z=_________ ;
Ⅱ.若将16.0g剩余固体继续加热到更高的温度,发现固体质量减少了1.6g后质量不再改变,写出此过程中可能发生反应的化学方程式:_____________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室现有氯酸钾、稀盐酸、二氧化锰、大理石、火柴、药匙、镊子及以下仪器:

(1)若要制备并检验二氧化碳,需补充一种溶液,该溶液中溶质为____________。
(2)若补充仪器__________和___________(填名称),并利用上述部分仪器和药品可制取一种气体,则发生反应的化学方程式为____________________________________。制取该气体时,需先检查装置的气密性:连接好仪器,将导管一端浸入水中,用手紧握容器外壁,使容器内温度_________,压强变______,观察到水中导管口有_____________时,说明装置不漏气。
(3)请将下列铁丝在氧气中燃烧和制取氧气的装置图补充完整。____________

查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列各组物质中,前者属于纯净物,后者属于混合物的是 ( )
A. 二氧化碳 澄清石灰水
B. 冰水混合物 五氧化二磷
C. 汽水 河水
D. 净化后的空气 受污染的空气
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室制取常见气体所需装置如下图所示,请回答有关问题。
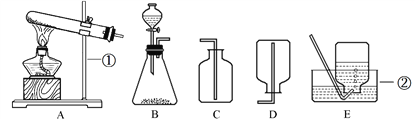
(1)写出图中标号仪器的名称: ①___,②___。
(2)实验室用A装置制氧气的化学方程式是___,收集装置是___(填字母)。
(3)实验室制取二氧化碳的化学方程式是___,装置的组合是___。
(4)实验室收集SO2可以选用C,据此可知:SO2具有的性质是__ ,由于SO2 ____,最好用下图F装置收集,应该是___管进气。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】初中常见的两种元素X、Y的相关信息如下:
元素 | X | Y |
相关信息 | 其单质甲是最轻的气体 | 地壳中含量最多的元素 |
(1)甲的化学式___________。
(2)下列关于X2Y和X3Y+ 两种粒子的说法中,正确的是__________(填序号)。
A质子总数相同 B 电子总数相同 C相对分子质量相同
(3)A、B、C是由上述两种元素组成的单质或化合物,它们之间的转化关系如图,其中A → C 为分解反应。(“ → ”表示转化,部分反应物和生成物及反应条件已略去)

则A → C的化学方程式________________________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】如图所示,烧杯中盛有质量相等、质量分数相等的稀盐酸,天平调平后,同时向其中分别加入等质量的锌片和铁片,则从反应开始到金属完全反应的过程中,天平指针指向的变化是( )

A. 向左偏 B. 向右偏
C. 先向左偏后向右偏 D. 先向右偏后向左偏
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在验证“二氧化碳与水反应生成碳酸”的实验中,设计了四个小实验,对它们的认识不正确的是(*注:四朵花均在紫色石蕊试液中浸泡过并晾干) ( )

A. 实验Ⅰ中紫色干花变为红色,只说明了紫色石蕊遇酸性物质变红,与本实验没有关
B. 实验II、III均为对照试验,说明水及二氧化碳都不能使紫色石蕊变色
C. 实验III中的二氧化碳可以是潮湿的,而实验IV中的二氧化碳必须是干燥的
D. 实验IV为验证实验,紫色干花变红色,说明二氧化碳与水反应生成了酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com