
| A. | 向氢氧化钠和稀盐酸的混合溶液中加入锌片没有气泡产生,由此可证明氢氧化钠和稀盐酸发生了化学反应 | |
| B. | 化学反应前后,分子和离子的种类可能发生改变,但原子的种类不变 | |
| C. | 湿衣服在太阳底下干得快,说明分子运动速率与温度有关 | |
| D. | 用玻璃棒蘸取食用白醋滴在湿润的pH试纸上,测定其pH值 |
分析 A、根据盐酸和氢氧化钠、锌会发生反应进行分析;
B、根据分子是保持物质化学性质的最小微粒,原子是化学变化中的最小微粒进行分析;
C、根据分子运动的快慢与温度有关进行分析;
D、根据用pH试纸测定溶液pH值时不能湿润进行分析.
解答 解:A、盐酸和氢氧化钠生成氯化钠和水,与锌会发生反应生成氢气,所以向氢氧化钠和稀盐酸的混合溶液中加入锌片没有气泡产生,由此可证明氢氧化钠和稀盐酸发生了化学反应,故A正确;
B、分子是保持物质化学性质的最小微粒,原子是化学变化中的最小微粒,所以化学反应前后,分子和离子的种类可能发生改变,但原子的种类不变,故B正确;
C、湿衣服在太阳底下干得快,说明分子运动速率与温度有关,故C正确;
D、用pH试纸测定溶液pH值时不能湿润,所以用玻璃棒蘸取食用白醋滴在湿润的pH试纸上,测定其pH值偏大,故D错误.
故选:D.
点评 本题主要考查了一些常见的实验操作,难度不大,需要加强识记.


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 步骤 | 实验操作 | 预期现象与结论 |
| 1 | 各取2mL反应后混合溶液分别加入A、B两支试管中 | / |
| 2 | 向A试管中滴加足量稀硫酸,随即滴加几滴红色品红溶液. | 有气泡产生,品红溶液褪色, 证明含有K2SO3. |
| 3 | 向B试管中,加入足量的氯化钡溶液,再加入足量稀盐酸. | 先有白色沉淀产生,后有气泡产生,沉淀部分溶解,证明含有K2SO4,则猜想3成立. |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
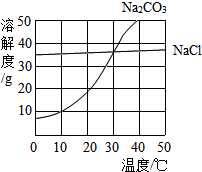 (1)30℃时,氯化钠的溶解度=碳酸钠的溶解度(填写“>”、“<”或“=”);
(1)30℃时,氯化钠的溶解度=碳酸钠的溶解度(填写“>”、“<”或“=”);查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com