
【题目】(9分)化学是研究物质组成、结构、性质及变化规律的基础自然学科。同学们以氯化钠为例进行研究
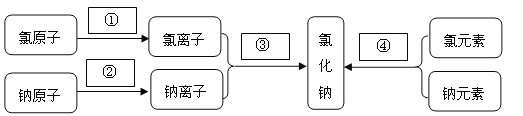
(1)研究物质的组成和结构:将失去电子、得到电子、构成和组成填在图中的空白处:
(2)研究物质的制备:将海水进行 可得到粗盐。除去粗盐中含有的SO42-、Ca2+、Mg2+等杂质,常加入过量的①过量的Na2CO3 溶液、② BaCl2溶液、③NaOH溶液,三种试剂的加入顺序为 (填序号)。碳酸钠和盐酸反应也能生成氯化钠,工业上不用此反应制备氯化钠的原因是 。
(3)研究变化规律:将氯化钠和水在通电条件下反应能生成一种碱、氢气和氯气(Cl2),该反应的化学方程式为 。
【答案】(1)①得到电子 ②失去电子 ③构成 ④组成
(2)蒸发结晶 ②③①或③②①或②①③ 碳酸钠、盐酸的成本比氯化钠高(或海水中富含氯化钠,成本低等)
(3)2NaCl +2H2O 通电2NaOH +2H2↑ + Cl 2↑
【解析】
试题分析:(1)①氯原子最外层电子数是7>4,故容易得到电子;②钠原子最外层电子数是1<4,容易失去电子;③从微观来讲:氯化钠由钠离子和氯离子构成;④从宏观来讲:氯化钠由钠元素和氯元素组成
(2)由于氯化钠的溶解度随温度的升高而变化不大,故从海水中得到粗盐采用蒸发结晶的方法;要除去粗盐中含有的SO42- 、Ca2+、Mg2+等杂质,常加入过量的①过量的Na2CO3 溶液(除去Ca2+及过量的BaCl2溶液)、② BaCl2溶液(除去SO42-)、③NaOH溶液(除去Mg2+),基于这种情况, 所以①过量的Na2CO3 溶液一定要放在② BaCl2溶液之后即可,故三种试剂的加入顺序为:②③①或③②①或②①③;碳酸钠和盐酸反应也能生成氯化钠,工业上不用此反应制备氯化钠的原因是:碳酸钠、盐酸的成本比氯化钠高(或海水中富含氯化钠,成本低等)
(3)将氯化钠和水在通电条件下反应能生成一种碱、氢气和氯气(Cl2),该反应的化学方程式为:2NaCl +2H2O 通电2NaOH +2H2↑ + Cl 2↑


 云南师大附小一线名师提优作业系列答案
云南师大附小一线名师提优作业系列答案 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案科目:初中化学 来源: 题型:
【题目】通过海水晾晒可得粗盐,粗盐除NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质。以下是制备精盐的实验方案,各步操作流程如下:
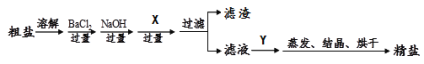
①加入过量的BaCl2溶液目的是 (11) ;
②加入试剂X 发生反应的化学方程式是 (12) ;
③加入试剂Y的化学式是 (13) ,请分别分析:Y不足量或过量时,对本实验是否有影响?请说明理由。 (14)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下图是氢氧化钠溶液和盐酸用滴加方式反应时,溶液pH随滴入溶液体积变化的曲线。
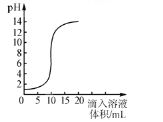
下列说法不正确的是
A.该实验是将氢氧化钠溶液滴入盐酸中
B.氢氧化钠溶液和盐酸恰好反应时,溶液PH=7
C.当滴加入20ml溶液时,再滴加石蕊试剂,溶液呈红色
D.当PH=12时,所得溶液的溶质为NaCl和NaOH
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(6分)一定条件下,某物质溶解于水的实验数据如下表,请回答有关问题。
实验序号 | 温度/℃ | 水的质量/g | 所加物质质量/g | 溶液质量/g |
① | 20 | 10 | 2 | 12 |
② | 20 | 15 | 2.5 | a |
③ | 20 | 20 | 7 | 26 |
④ | 30 | 20 | 7 | 27 |
(1)表中a= 。
(2)20℃时,该物质的溶解度为 。
(3)下图中,能表示该物质溶解度的曲线是 (填字母)。
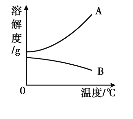
(4)所得溶液一定为饱和溶液的是 (填实验序号,下同);所得溶液中溶质质量分数最大的是 。
(5)温度不变,将①、②所得溶液混合后,向其中再加入 g该物质,能使溶液恰好达到饱和。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】据有关资料介绍,儿童缺钙会得佝偻病,成年人缺钙会得软骨病,血液中也有少量钙,它对皮肤伤口血液的凝固起着重要作用;人体缺碘会引起甲状腺肿大.这里的“钙”、“碘”是指( )
A.单质 B.元素 C.原子 D.分子
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】 如图四个图象中能正确反应其对应实验操作的是
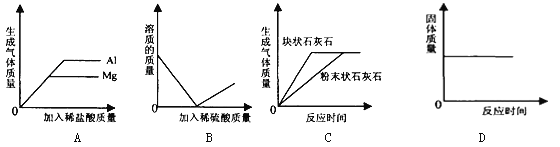
A.向等质量的铝粉和镁粉中分别滴入质量分数相同的足量的稀盐酸
B.向一定量的氢氧化钡溶液中不断加入稀硫酸
C.等质量的块状石灰石和粉末状石灰石分别与质量分数相同的足量的稀盐酸反应
D.碳和氧化铜的固体混合物在高温条件下反应
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】(4分)生活中有许多铜制品,如:铜暖手炉、铜雕塑、铜芯线、铜工艺品等等。
(1)其中作铜芯线是利用了铜的 (物理性质) 。
(2)东汉晚期的青铜奔马(马踏飞燕)是我国的旅游标志,但由于时间过长已经满身“绿锈”。和铁生锈类似,铜在空气中被腐蚀生成了绿色的碱式碳酸铜![]() ,根据它的组成判断,可能是铜和空气中的 、 、 (填化学式)共同发生了化学反应。
,根据它的组成判断,可能是铜和空气中的 、 、 (填化学式)共同发生了化学反应。
(3)孔雀石是一种主要含有绿色碱式碳酸铜的矿石。人们发现:森林火灾后,孔雀石表明往往有红色物质出现。提示:Cu2(OH)2CO3===2CuO+H2O+CO2↑试写出产生红色物质的其中一个化学方程式 。
(4)碱式碳酸铜又可以表示为![]() ,取少量碱式碳酸铜溶于适量稀盐酸中,得到蓝色的溶液,其溶质为 (填化学式)。
,取少量碱式碳酸铜溶于适量稀盐酸中,得到蓝色的溶液,其溶质为 (填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com