
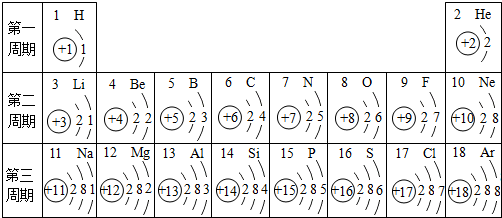
分析 (1)根据元素的化学性质跟它的原子的最外层电子数目关系非常密切,最外层电子数相同的元素化学性质相似;据此进行分析解答.
(2)由在第三周期中元素的分类,钠、镁、铝属于金属元素,硅、磷、硫、氯属于非金属元素,氩属于稀有气体元素,进行分析解答.
(3)第11号元素与第17号元素分别是钠元素和氯元素,组成的化合物是氯化钠,据此进行分析解答.
解答 解:(1)元素的化学性质跟它的原子的最外层电子数目关系非常密切,最外层电子数相同的元素化学性质相似,氧元素与硫元素化学性质相似,主要是因为它们的最外层电子数相同.
(2)在第三周期中,钠、镁、铝属于金属元素,硅、磷、硫、氯属于非金属元素,氩属于稀有气体元素,元素类型的变化情况是:从左到右由金属元素过渡到非金属元素,并以稀有气体元素结束.
(3)第11号元素与第17号元素分别是钠元素和氯元素,组成的化合物是氯化钠;氯化钠是由钠离子和氯离子构成的.
故答案为:(1)它们的最外层电子数相同;(2)金属;非金属;(3)氯化钠;离子.
点评 本题难度不大,考查学生灵活运用元素周期表中元素的信息、常见物质的粒子构成等进行分析解题的能力.


科目:初中化学 来源: 题型:选择题
 如图,向小试管中加入一定量的下列物质,U型管右侧液面高出左侧液面,则加入的物质是( )
如图,向小试管中加入一定量的下列物质,U型管右侧液面高出左侧液面,则加入的物质是( )| A. | 硝酸铵固体 | B. | 蔗糖固体 | C. | 氯化钠固体 | D. | 氢氧化钠固体 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 木材燃烧余下灰烬的质量小于原木材的质量 | |
| B. | 24克镁与32克氧气充分反应可以生成56克氧化镁 | |
| C. | 所有化学反应都遵从质量守恒定律 | |
| D. | 有气体参加或有气体生成的反应只有在密闭容器中才能用来验证质量守恒定律 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com