
某校科学兴趣小组为测定某样品中氯化铵的质量分数,将6g样品溶于18g水后,再加入7.6g氢氧化钠浓溶液共热,两者恰好完全反应(样品中的杂质不与氢氧化钠反应,也不溶于水.)把产生的所有NH3用足量的硫酸溶液完全吸收,同时测量120秒内硫酸溶液增加的质量,结果如下表所示.
| 时间/s | 0 | 20 | 30 | 40 | 60 | 80 | 100 | 120 |
| 硫酸溶液增加的质量/g | 0 | 0.7 | 1.0 | 1.2 | 1.5 | 1.6 | 1.7 | 1.7 |
试回答下列问题:
(1)样品中氯化铵的质量分数;
(2)求反应后所得氯化钠溶液的溶质质量分数(不考虑反应过程中水分的损失).
 NaCl+H2O+NH3↑
NaCl+H2O+NH3↑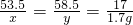
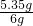 ×100%≈89.2%;
×100%≈89.2%;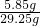 ×100%=20%.
×100%=20%.

科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com