
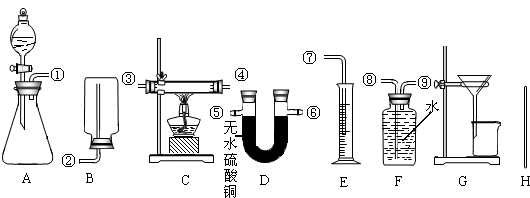
| 选用药品的名称(1) | 选用的实验装置及组装时接口的连接顺序(2) | 需测得的实验数据(从上述可测得的数据中选取)(3) | 合金中锌的质量分数的计算式(4) | ||
| 选用的实验装置序号 | 组装时接口编号的连接顺序(如不需要组装,则不填) | ||||
| 方案一 | |||||
| 方案二 | |||||
| 方案三 | |||||
 ×100%;
×100%;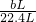 ×2.0g=
×2.0g=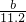 g算出氢气质量,再根据方程式由氢气质量算出锌的质量,设参加反应的锌的质量为X:
g算出氢气质量,再根据方程式由氢气质量算出锌的质量,设参加反应的锌的质量为X:
 ,解得X=
,解得X=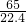
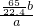 ×100%;
×100%;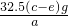 ×100%.
×100%. ×100%;
×100%;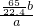 ×100%;
×100%;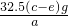 ×100%.
×100%.

科目:初中化学 来源: 题型:
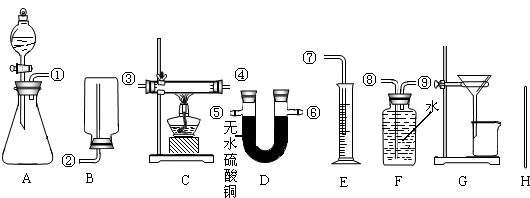
| 选用药品的名称(1) | 选用的实验装置及组装时接口的连接顺序(2) | 需测得的实验数据(从上述可测得的数据中选取)(3) | 合金中锌的质量分数的计算式(4) | ||
| 选用的实验装置序号 | 组装时接口编号的连接顺序(如不需要组装,则不填) | ||||
| 方案一 | |||||
| 方案二 | |||||
| 方案三 | |||||
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

| 方案 | 选用的药品 | 选用的实验装置及组装时接口连接顺序 | 需测得的实验数据(从上述可测得的数据中选取) | 混合物中Na2CO3的质量分数计算式 | |||||
| 选用的实验装置序号 | 组装时接口编号顺序 | ||||||||
| 一 | CaCl2溶液 CaCl2溶液 |
A、B、D、F | (毋须填写) | ag、bg ag、bg |
| ||||
| 二 | 稀H2SO4 稀H2SO4 |
A、C、E A、C、E |
①④⑤②③ ①④⑤②③ |
ag、cg、dg |
| ||||
查看答案和解析>>
科目:初中化学 来源: 题型:解答题

| 方案 | 选用的药品 | 选用的实验装置及组装时接口连接顺序 | 需测得的实验数据(从上述可测得的数据中选取) | 混合物中Na2CO3的质量分数计算式 | |
| 选用的实验装置序号 | 组装时接口编号顺序 | ||||
| 一 | ________ | A、B、D、F | (毋须填写) | ________ | ________ |
| 二 | ________ | ________ | ________ | ag、cg、dg | ________ |
查看答案和解析>>
科目:初中化学 来源:2005年第十五届“天原杯”全国初中学生化学素质和实验能力竞赛(湖南赛区)初赛试卷(解析版) 题型:解答题
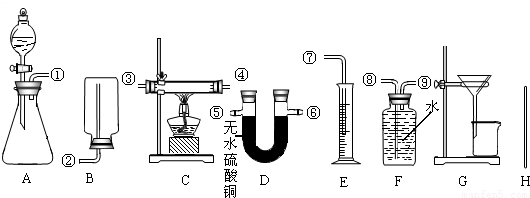
| 选用药品的名称(1) | 选用的实验装置及组装时接口的连接顺序(2) | 需测得的实验数据(从上述可测得的数据中选取)(3) | 合金中锌的质量分数的计算式(4) | ||
| 选用的实验装置序号 | 组装时接口编号的连接顺序(如不需要组装,则不填) | ||||
| 方案一 | |||||
| 方案二 | |||||
| 方案三 | |||||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com