
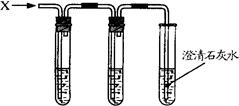
(8分)用盐酸和碳酸钙固体反应,将得到的气体X通入澄清石灰水中,始终没有发现石灰水变浑浊。针对此现象,同学们提出了自己的想法。
[查资料]稀盐酸与AgNO3溶液发生复分解反应,AgCl为白色且难溶于水。
[假设]小明的假设:澄清石灰水已变质。
小白的假设:气体X中除了有CO2外,还有 。
[实验探究](1)小明的探究:
| 实验目的 | 实验步骤 | 可能的实验现象 | 化学方程式和实验结沦 |
| 探究所用 澄清石灰 水是否变 质 | ①用一支试管另取少量原澄清石灰水 ②取稀硫酸与碳酸钠反应制取CO2 ③ | 步骤③中现象为: | 步骤②中反应方程式为: 实验结论:所用的澄清石灰水没有变质。 |
| 实验目的 | 实验步骤 | 实验现象 | 化学方程式和实验结论 |
| 探究小白的假设是否成立 | 将气体X通入AgNO3溶液 | | 反应方程式为: 实验结论:小白的假设成立 |
HCl
(1) .小明的探究:
(2).小白的探究实验目的 实验步骤 可能的实验现象 化学方程式和实验结沦 探究所用澄清石灰水是否变质 ③将产生的气体通入所用澄清石灰水中
步骤③中现象为:
澄清石灰水变浑浊步骤②中反应方程式为:
H2SO4+Na2CO3=Na2SO4+
H2O+CO2↑
(3)如果A浑浊B澄清,C浑浊,结论是 X中有HCl杂质,石灰水未变质; 实验目的 实验步骤 实验现象 化学方程式和实验结论 探究小白的假设是否成立
将气体X通入AgNO3
溶液
有白色沉淀生成 反应方程式为: HCl+AgNO3=AgCl↓+HNO3
如果A浑浊,B澄清,C澄清,小明和小白的假设都成立。
解析试题分析:[假设]由于盐酸具有挥发性,会导致生成的气体X中,除了含有CO2外,还可能含有氯化氢气体;
[实验探究]
(1)②稀硫酸与碳酸钠反应生成硫酸钠、水和二氧化碳,故反应的化学方程式是H2SO4+Na2CO3=Na2SO4+H2O+CO2↑;由于该实验的结论是:所用的澄清石灰水没有变质,所以应该把生成的二氧化碳气体通入澄清的石灰水中,可观察到石灰水变浑浊,说明石灰水没变质;
(2)由于该实验的结论是:小白的假设成立,即气体X中还含有氯化氢气体,故将气体X通入硝酸银溶液,可看到硝酸银溶液中会有白色沉淀生成(HCl+AgNO3=AgCl↓+HNO3),说明有氯化氢气体。
[实验反思](3)根据图示分析,试管A中放入硝酸银溶液是用来检验X气体中是否有氯化氢气体的存在,试管B中放入硝酸银溶液则是检验氯化氢气体是否被完全除掉,而试管C则是来检验二氧化碳的存在;所以,如果A浑浊、B澄清、C浑浊,则可以得出的结论为X为氯化氢和二氧化碳的混合气体,石灰水未变质;若小明和小白的假设都成立,说明石灰水已变质,而X为氯化氢和二氧化碳的混合气体,所以现象是:试管C中的石灰水不会变浑浊,试管A变浑浊,试管B不变浑浊。
考点:药品是否变质的探究,常见气体的检验与除杂方法,酸的物理性质及用途,碱的化学性质,书写化学方程式
点评:本题以实验探究的形式考查二氧化碳制取中可能出现的问题和解决验证的方法,要求同学们要具有扎实的基础知识和技能,以及综合分析问题的能力;对于这类对于验证型实验探究,要熟记物质的性质或变化规律,根据给出的实验设计方案,进行实验、分析和探究,并通过观察、记录和分析的实验现象,来验证该物质的性质或变化规律等。


科目:初中化学 来源: 题型:阅读理解
| 物质 | X | Y | Z | Q |
| 反应前质量(g) | 40.0 | 4.6 | 37.8 | 0.0 |
| 反应后质量(g) | 43.6 | 待测数据 | 4.2 | 8.8 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
 做化学实验时,实验台上的药品应分类有序地摆放.在一次化学兴趣小组活动中,实验台上摆放了下列药品,(1)盐酸,(2)硫酸,(3)氢氧化钾,(4)氢氧化钙,(5)硝酸银,(6)
做化学实验时,实验台上的药品应分类有序地摆放.在一次化学兴趣小组活动中,实验台上摆放了下列药品,(1)盐酸,(2)硫酸,(3)氢氧化钾,(4)氢氧化钙,(5)硝酸银,(6)| 选用试剂(填入序号) | 实验现象 | 结论 |
| 产生大量气泡 | 原试剂是Na2CO3溶液. |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| ||
| ||
| ||
| 密度(ρ)/g?ml-1 | 1.00 | 1.02 | 1.04 | 1.06 | 1.08 | 1.10 | 1.12 | 1.14 | 1.16 | 1.185 |
| 溶质质量分数(w)/% | 0.4 | 4.4 | 8.5 | 12.5 | 16.5 | 20.4 | 24.2 | 28.2 | 32.2 | 37.2 |
查看答案和解析>>
科目:初中化学 来源:2011-2012学年江苏省苏州市初三中考二模化学试卷(解析版) 题型:填空题
(8分)对碳酸钙、碳酸氢铵、碱式碳酸铜三种碳酸盐的性质比较:
在1、2、3三试管中依次加入碳酸钙、碳酸氢铵、碱式碳酸铜各少量固体(各2份)。
第一份:在1、2、3三试管中各倒入少些水并振荡至充分溶解,用玻璃棒蘸取液体并与标准比色卡对照,可测定三种物质的pH 。实验时要多次使用玻璃棒,所以,每次测定后应对玻璃棒进行 处理。根据你的实验结果,可以得出上述三种碳酸盐水溶液的pH由大到小的顺序是(填试管编号):
试管 >试管 >试管 。(1分)
将1、2、3三试管置于烧杯内热水水浴。根据你的实验结果和学过的知识,可以得出
三种碳酸盐的热稳定性由强至弱的顺序是(填化学式):
> > 。(1分)
按盐的组成分类,碳酸钙、碳酸氢铵、碱式碳酸铜依次为正盐、酸式盐和碱式盐。初步推想,正盐、酸式盐和碱式盐的热稳定性由强至弱的顺序应该是:
> > 。(1分)
第二份:在1、2、3三试管中分别加入稀盐酸,都能观察到 。
要鉴定该气体,你的操作方法是: 。
碳酸钙和适量稀盐酸反应至气泡逸出不明显后,测得其残留液pH等于2。 此时取适量
反应后溶液,逐滴滴入碳酸钠溶液,并用pH数字探测仪连续监测,得曲线如下[ pH为纵坐标,时间s(秒)为横坐标]:
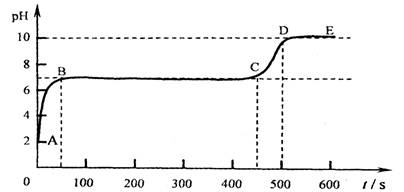
①写出BC“平台”段化学方程式 ;
②CD段上升的原因是: 。
查看答案和解析>>
科目:初中化学 来源:2010年宁夏银川市九年级上学期期末检测化学卷 题型:实验探究题
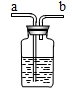
(8分)某实验小组的同学用碳酸钠粉末、粒状大理石、稀盐酸、浓盐酸、稀硫酸这几种药品,探究哪两种药品的反应适合在实验室制取CO2气体。请你参与下列的探究并回答问题。
[提出问题]上述酸和碳酸盐的反应是否适合在实验室制取CO2气体。
[方案设计]大家经过讨论,一致认为浓盐酸不适合用于实验室制取CO2气体,原因是浓盐酸挥发出的HCl气体混于CO2中,使制得的气体不纯。小明设计了下图装置来除去CO2中HCl,

洗气瓶中盛装的液体可以是 (填序号)
①浓硫酸 ②碳酸氢钠溶液
③氢氧化钠溶液 ④澄清石灰水
[实验与结论]
该小组设计了三个实验进行对比

(1)请你填写实验C的实验现象和实验结论
|
实验 |
实验现象 |
实验结论 |
|
A |
剧烈反应,迅速放出大量气体 |
反应速度过快,气体不便收集,不宜用于实验室制取CO2 |
|
B |
产生气泡,速度迅速减慢,几秒钟后反应几乎停止 |
无法持续产生气体,不能用于实验室制取CO2 |
|
C |
|
|
(2)根据实验探究,实验室制取CO2的化学反应原理为(用化学方程式表示)
[拓展迁移]
将上述实验C反应后的混合物过滤。对滤液中的溶质,小聪同学提出了以下三种猜想:
①溶质是HCl;②溶质是CaCl2;③溶质是HCl和CaCl2
该小组成员一起讨论后认为,上述三种猜想中有一种是不合理的,你认为不合理的猜想是 (填序号)。对小聪的另外两种合理猜想,请你设计实验,并根据不同现象说明溶液中的溶质属于哪一种猜想。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com