
分析 煤、石油、天然气属于化石燃料,煤被称为工业的粮食,石油被称为工业的血液,天然气的主要成份是甲烷,可以根据质量守恒定律正确的书写化学方程式.
解答 解:煤、石油、天然气是当今世界上最重要的化石燃料,石油被人们称为“工业的血液”.天然气的主要成份是甲烷,天然气燃烧生成二氧化碳和水,化学方程式为:CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O,
故填:煤、石油、天然气; 石油;甲烷;CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O;
点评 解答本题的关键是要掌握化石燃料的分类方法和化学方程式的书写方法,只有这样才能对问题做出正确的判断.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
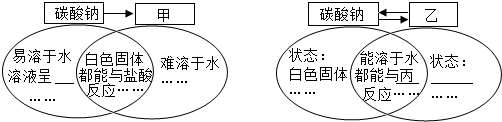
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
| 溶剂 | NaOH | Na2CO3 |
| 水 | 109 | 21.8 |
| 酒精 | 17.3 | <0.01 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题

查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
| 实验编号 | 实验药品 | 分解温度(℃) |
| ① | KClO3 | 580 |
| ② | KClO3、MnO2(质量比1:1) | 350 |
| ③ | KClO3、CuO(质量比1:1) | |
| ④ | KClO3、Fe2O3(质量比1:1) | 390 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
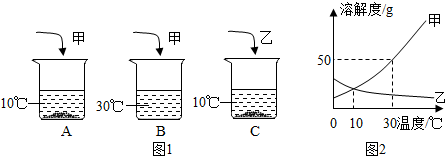
| A. | A、C烧杯中溶质质量分数一定相等 | |
| B. | B烧杯中的溶液一定是不饱和溶液 | |
| C. | C烧杯中溶液的溶质质量分数一定为10% | |
| D. | 升温后A、C两种溶液均可变为不饱和溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com