
【题目】化学物质在生活、生产中,以及对人类的健康有着很重要的作用.
(1)碳酸钙可以作为补钙剂,该物质所含酸根的符号是_____.
(2)医用0.9%氯化钠注射液,常含有碳酸氢钠或乳酸钠(C3H5O3Na),其中碳酸氢钠属于___(填“酸”或“碱”或“盐”),乳酸钠中碳元素与氧元素的质量比是_____.
(3)铁锅是有益于人类健康的理想炊具,烹调后留有的铁单质进入胃后,发生反应的化学方程式是____,FeCl2的化学名称是____.
(4)尿素____铵态氮肥(填“属于”、“不属于”),化学式为____,____(填“能”或“不能”)与草木灰等碱性物质混合使用.
(5)奶制品厂收购牛奶时,通过测定含氮量来确定牛奶中蛋白质含量的等级,这里的“氮”是指___.
(6)中和酸性土壤的碱是___;做调味品的盐是___;自来水生产中使用氯气的作用是___;生石灰可作食品干燥剂,其原理是____;活性炭可用来除臭、滤毒等,都是利用它的___.
(7)水参加植物光合作用化学方程式为:6CO2+6H2O![]() 6O2+X,则X的化学式____.
6O2+X,则X的化学式____.
用水鉴别NaOH、NaCl、CaCO3三种固体物质时,能够鉴别出NaOH固体所依据的现象是___.
(8)不法分子常用“铜﹣锌合金”冒充黄金欺骗消费者,请你写出鉴别“铜﹣锌合金”和黄金的两种方法:A____.B____.
【答案】CO32- 盐 3:4 Fe+2HCl=FeCl2+H2↑ 氯化亚铁 不属于 CO(NH2)2 能 元素 氢氧化钙 氯化钠 杀菌消毒 可与水反应 吸附性 C6H12O6 液体的温度显著升高 将两种物质分别放入稀盐酸中,有气泡产生的是铜﹣锌合金,无气泡产生的是金 分别给两种物质加热,物质变为黑色的是铜﹣锌合金,没有发生颜色变化的是金
【解析】
(1)碳酸钙中含有碳酸根,碳酸根的符号是CO32-。
(2)碳酸氢钠属于盐,乳酸钠中碳元素与氧元素的质量比是(12×3):(16×3)=3:4
(3)胃内含有盐酸,铁锅是有益于人类健康的理想炊具,烹调后留有的铁单质进入胃后,发生反应的化学方程式为:Fe+2HCl=FeCl2+H2↑,FeCl2的化学名称是氯化亚铁。
(4)铵态氮肥中含有铵根离子,尿素中无铵根离子,不属于铵态氮肥,化学式为CO(NH2)2,铵态氮肥不能与草木灰等碱性物质混合使用,尿素能与草木灰等碱性物质混合使用。
(5)奶制品厂收购牛奶时,通过测定含氮量来确定牛奶中蛋白质含量的等级,这里的“氮”是指元素。
(6)中和酸性土壤的碱是氢氧化钙;做调味品的盐是氯化钠;自来水生产中使用氯气的作用是杀菌消毒;生石灰可作食品干燥剂,其原理是可与水反应;活性炭可用来除臭、滤毒等,都是利用它的吸附性。
(7)化学反应前后各种原子个数相等,6CO2+6H2O![]() 6O2+X,故X的化学式为C6H12O6。
6O2+X,故X的化学式为C6H12O6。
NaOH固体溶于水放出大量的热,用水鉴别NaOH、NaCl、CaCO3三种固体物质时,能够鉴别出NaOH固体,所依据的现象是液体的温度显著升高。
(8)A 锌能与稀盐酸反应产生气体而冒气泡,而金不与稀盐酸反应,可将两种物质分别放入稀盐酸中,有气泡产生的是铜﹣锌合金,无气泡产生的是金。B 金即使加热到高温也不与氧气反应,而铜在加热时,与氧气反应生成黑色的氧化铜,可分别加热两种物质,物质变为黑色的是铜﹣锌合金,没有发生颜色变化的是金。


 新编小学单元自测题系列答案
新编小学单元自测题系列答案 字词句段篇系列答案
字词句段篇系列答案科目:初中化学 来源: 题型:
【题目】海洋是人类的巨大资源宝库,试回答下列相关向题:
(1)海水淡化:下图为太阳能海水淡化装置:
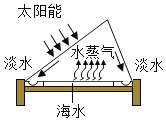
①该海水淡化过程,相当于实验室中的_______(填“蒸发”或“蒸馏”)。
②下列分离混合物的常用方法中,原理与上述方法相同的是______(填序号)。
A 过滤法净化水 B 工业法制氧气 C 活性炭吸附
(2)海水制镁。下图是由海水制备金属镁的工业流程:
![]()
涉及的主要步骤有:①电解熔融的氯化镁②加石灰乳③加盐酸④过滤⑤蒸发结晶
其先后顺序正确的是______
A ②④③⑤① B ②④①⑤③ C ②③④⑤① D ③②④①⑤
(3)海水晒盐:所得粗盐中常含有泥沙等难溶性杂质,可通过溶解、过滤、______等操作去除。这样得到的食盐品体中仍含可溶性杂质![]() ,工业上选用试剂________对其进行除杂.
,工业上选用试剂________对其进行除杂.
(4)海水制“碱”:1926年,我国著名化学家________创立了侯氏制碱法,以管盐为主要原料制取纯碱。生产过程中,先向饱和食盐水中通氨气,再通二氧化碳,涉及的反应原理如下:
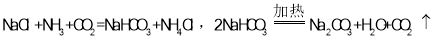
试回答下列问题:
①向饱和食盐水中先通氨气,再通二氧化碳的原因是________.
②纯碱在生活生产中用途广泛。试写出工业上利用纯碱与熟石灰反应制取烧碱的化学方程式:________
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】豆腐是人们喜爱的食物,营养丰富,能为人体提供所需的多种氨基酸,其中含量最多的是亮氨酸(![]() ),下列关于亮氨酸的说法中,正确的是( )
),下列关于亮氨酸的说法中,正确的是( )
A.亮氨酸是一种氧化物
B.亮氨酸中氢元素的质量分数最大
C.一个亮氨酸分子由22个原子构成
D.亮氨酸中碳、氧两种元素的质量比为3:1
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】基本的实验技能是学习化学和进行科学探究的基础和保证,如图为配制一定质量分数的氯化钠溶液的操作示意图,请根据图示回答问题:
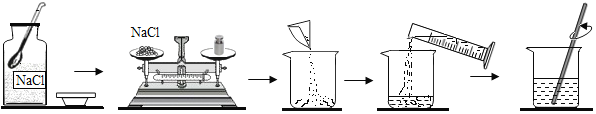
(1)取用固体粉末状药品应用___________。
(2)图中玻璃棒的作用是______________。
(3)准确读取量筒内液体体积的方法是_____________。
(4)称取药品时,若药品和砝码的位置放反了(使用了游码),则实际值比测量值_____(填“偏大”或“偏小”或“不变”);
(5)溶液配制好以后,将烧杯中的溶液装入试剂瓶时不慎洒出一部分,试剂瓶中溶液的溶质的质量分数会______(填“增大”或“减小”或“不变”)。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】某兴趣小组为测定实验室中一瓶久置的过氧化氢溶液的溶质的质量分数,实验测得相关数据如图所示:

(1)反应生成氧气的质量为_____________g;
(2)计算该过氧化氢溶液中溶质质量分数_____________;
(3)实验表明硫酸铜溶液在该反应中也能起到二氧化锰的作用。若用5.6g无水硫酸铜代替二氧化锰进行本实验,计算剩余的溶液中溶质的质量分数_____________。(硫酸铜全部溶于水,计算时保留到0.1%)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列叙述对应的化学方程式、所属基本反应类型都正确的是( )
A.服用含氢氧化铝的药物治疗胃酸过多 Al(OH)3+3HCl=AlCl3+3H2O 复分解反应
B.不能用铁桶盛放波尔多液 Fe+CuSO4=Cu+FeSO4 分解反应
C.用天然气作燃料 CH4+O2![]() CO2+2H2O 氧化反应
CO2+2H2O 氧化反应
D.验证铜和铝的活动性 3Cu+A12(SO4)3=3CuSO4+2Al 置换反应
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】在化学课上,甲同学将燃烧的钠迅速伸入到盛有CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上粘附着白色物质。
【提出问题】黑色颗粒和白色物质是什么?
【进行猜想】甲认为黑色颗粒是____,白色物质可能是(1)Na2O(2)碳酸钠
(3)___________________乙同学认为白色物质可能是氢氧化钠。甲同学立刻认为乙同学的猜想是错误的,其理由是_______________________________。
【查阅资料】氧化钠为白色粉末,溶于水生成氢氧化钠: Na2O+H2O == 2NaOH
【实验探究】甲同学对白色物质进行实验探究。
实验方案 | 实验操作 | 实验现象 | 结论 |
方案1 | 取样品少量于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 | _______ | 白色物质 为氧化钠。 |
方案2 | ①取样品少量于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 | _______ | 白色物质 是碳酸钠。 |
②静置片刻,取上层清液于试管中,滴加无色酚酞试液 | _______ |
【反思评价】丙同学认为方案1得到的结论不正确,其理由是_____________________。
【得出结论】钠在二氧化碳中燃烧的化学方程式为____________________________。由钠在二氧化碳中燃烧的实验还能得出什么结论?_________________(任意写一个)
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】黄铜是铜和锌的合金,可以用来制造机器、电器零件及日用品.为了测定某黄铜样品中铜的质量分数,取20g该样品向其中加入一定量的稀硫酸,恰好完全反应,产生氢气的质量与加入稀硫酸的质量关系如图所示.

请解答下列问题:
(1)完全反应后,生成H2的质量为____g。
(2)该黄铜样品中铜的质量分数为__________?
(3)完全反应后所得溶液的溶质质量分数是___________?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】实验室有一瓶试剂的标签破损不清如图,甲、乙、丙三位同学对它的主要成分进行讨论, 一起猜想。
甲同学认为:该试剂主要成分是酸;
乙同学认为:该试剂主要成分是碱;
丙同学认为:该试剂主要成分是盐;
(1)你认为_____同学的猜想是错误的;
(2)丙同学证实该物质是一种氮肥,则化学式是_____;
(3)甲同学对有关盐的知识进行了以下的整理。
氯化钾 | 氯化钙 | 氯化钠 | 氯化镁 | 氯化铝 | 氯化锌 | 氯化亚铁 | 氯化铜 |
KCl | CaCl2 | NaCl | MgCl2 | AlCl3 | ZnCl2 | FeCl2 | CuCl2 |
反思:
①根据以上盐中的金属元素的排列,可以得出是依据_____顺序归纳整理的。
②酸在水溶液中能解离出H+,因此酸溶液具有相似的化学性质。据此分析上述盐溶液也会具有相似的化学性质,写出一种与上述盐溶液均能发生反应的物质的名称:_____。
(4)小组同学探究:除去固体氯化钠中混有的氯化钙。设计实验方案如下,请参与实验并回答问题。
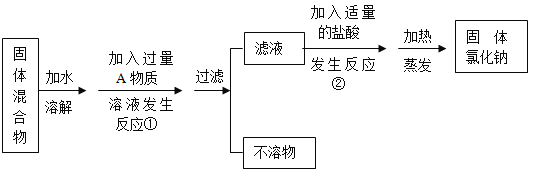
a.写出A物质的化学式:_____;b.反应②中如果加入的稀盐酸也过量,则对所得到的氯化钠纯度_____(选填“有”或“没有”)影响;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com