解:(1)t
1℃时,甲的溶解度小于乙的溶解度;
(2)甲的溶解度随温度的升高而增大,要使接近饱和的甲溶液变为饱和溶液,可采取增加溶质,降低温度,蒸发溶剂的方法;
增加溶质、降低温度,溶剂的质量不变,故A错误;降低温度恰好饱和,则溶质的质量不变,增加溶质则溶质的质量增加,故溶质的质量可能不变,B正确;若采取降温恰好饱和的方法,则溶液的溶质质量分数不变,故C错误;甲的饱和溶液是一定温度下不能继续溶解甲的溶液,但不是其他物质的饱和溶液,故可溶解其他物质,D正确;
(3)t
3℃时乙的溶解度是Wg,甲的溶解度大于Wg,故甲、乙各Wg分别加入到两只盛有100g水的烧杯中,充分搅拌所得乙溶液为饱和溶液;t
2℃时甲、乙的溶解度相等,均小于Wg,由饱和溶液中溶质的质量分数计算式可知:溶解度相等,则溶质的质量分数也相等,所以若将温度都降低到t
2℃,甲溶液中溶质的质量分数=乙溶液中溶质的质量分数;
(4)甲的溶解度受温度影响大,乙的溶解度受温度影响变化小,所以若甲中混有少量乙,可用降温结晶的方法提纯甲;
故答案为:(1)小于;
(2)BD;
(3)饱和;等于;
(4)降温结晶(或冷却热饱和溶液).
分析:(1)据溶解度曲线可以比较某温度下物质的溶解度;
(2)据物质的溶解度随温度变化情况及不饱和溶液转化为饱和溶液的方法分析解答;
(3)据t
3℃时甲、乙的溶解度分析判断;并结合t
2℃时甲、乙的溶解度与Wg的大小分析解答,饱和溶液中溶质的质量分数

×100%;
(4)据甲和乙的溶解度随温度变化情况分析提纯甲的方法.
点评:了解溶解度曲线的意义并会应用解答相关问题,尤其是升温、降温后溶液溶质的质量分数变化问题更要认真分析.

 如图是甲、乙两种固体物质的溶解度曲线.
如图是甲、乙两种固体物质的溶解度曲线. ×100%;
×100%;

 阅读快车系列答案
阅读快车系列答案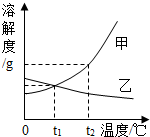 (2013?市中区一模)水是生命之源,生产之要,生活之基.泉城市民更要珍惜水、节约水、保护水.请完成下列问题:
(2013?市中区一模)水是生命之源,生产之要,生活之基.泉城市民更要珍惜水、节约水、保护水.请完成下列问题: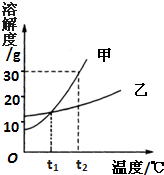 如图是甲、乙两种固体物质的溶解度曲线.
如图是甲、乙两种固体物质的溶解度曲线.