
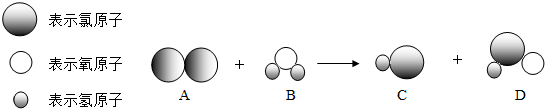
分析 (1)根据物质的微观构成分析代表次氯酸(HClO)的图示;
(2)观察反应微观图,分析反应物、生成物,写出反应的化学方程式;
(3)根据方程式,由A物质的质量求出生成次氯酸的质量;
(4)根据盐酸与硝酸银的反应,写出反应的化学方程式.
解答 解:(1)由物质的微观构成可知,代表次氯酸(HClO)的是D.
(2)由自来水消毒过程中发生反应的微观图可知,该反应是氯气与水反应生成了盐酸和次氯酸,化学方程式为:Cl2+H2O═HCl+HClO.
(3)设生成的次氯酸的质量为x
Cl2+H2O═HCl+HClO
71 52.5
142g x
$\frac{71}{52.5}=\frac{142g}{x}$ 解得:x=105g
(4)盐酸能与硝酸银反应生成了氯化银白色沉淀和硝酸,化学方程式为:HCl+AgNO3═AgCl↓+HNO3.
故答为:(1)D;(2)Cl2+H2O═HCl+HClO;(3)105;(4)HCl+AgNO3═AgCl↓+HNO3.
点评 本题综合性较强,但由于问题较多,容易被弄糊涂了,因此要从概念的科学定义出发,逐一解答.对于方程式书写的解答要注意配平,不能光看图示,否则容易出错.


科目:初中化学 来源: 题型:解答题
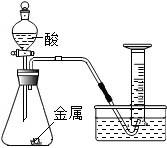 某化学兴趣小组探究“影响金属与酸反应速率的因素”,请你参与并回答问题:
某化学兴趣小组探究“影响金属与酸反应速率的因素”,请你参与并回答问题:| 实验编号 | 选用金属 (均取2g) | 盐酸质量分数(均取50mL) | 每分钟产生氢气的体积/mL | |||||
| 0~1min | 1~2min | 2~3min | 3~4min | 4~5min | 前5min共收集气体 | |||
| Ⅰ | 锌片 | 10% | 2.9 | 16.9 | 11.9 | 9.2 | 7.6 | 47.6 |
| Ⅱ | 锌片 | 5% | 1.6 | 8.4 | 5.9 | 4.8 | 3.7 | 24.4 |
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | Al2O3 | B. | Fe | C. | Fe2O3 | D. | Al |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 用稀盐酸区分铜和黄铜 | |
| B. | 用肥皂水区分硬水和软水 | |
| C. | 用水区分生石灰和硝酸铵固体 | |
| D. | 用酚酞溶液区分纯碱溶液和烧碱溶液 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 香菇精分子是由C、H、S三种元素组成的 | |
| B. | 香菇精是由8个碳原子、4个氢原子和5个硫原子构成 | |
| C. | 香菇精中氢元素的质量分数最小 | |
| D. | 香菇精的相对分子质量为261 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
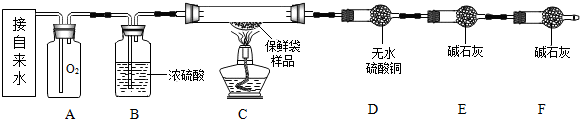
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
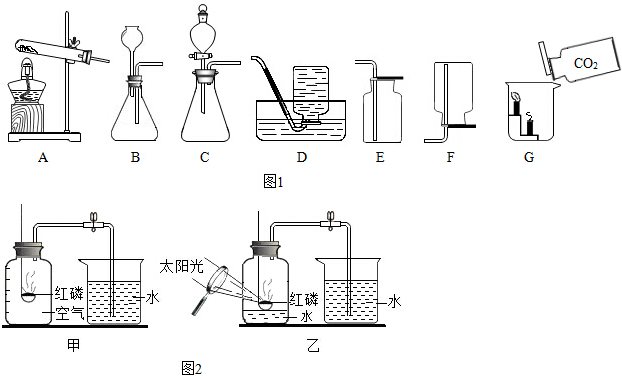
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com