现有一包只含有氯化钠杂质的纯碱样品.某校化学兴趣小组的同学为测定该纯碱样品的纯度,称取该纯碱样品12g于烧杯中,充分溶解于100mL水中(水的密度是1g/cm3),再加入足量的100g稀盐酸溶液,烧杯中剩余物质量为207.6g,试计算:
(1)纯碱样品的纯度?
(2)所取盐酸的溶质质量分数至少为多少?
【答案】
分析:依据反应前后物质的质量变化求出生成的二氧化碳质量,利用二氧化碳的质量可以求出碳酸钠和氯化氢的质量即可求出要解答的问题答案;
解答:解:碳酸钠与盐酸反应能够生成二氧化碳,故反应前后物质的质量之差即为反应产生的二氧化碳质量,则二氧化碳的质量=12g+100mL×1g/mL+100g-207.6g=4.4g
设样品中碳酸钠的质量是x,反应的氯化氢质量是y
Na
2CO
3+2HCl═2NaCl+CO
2↑+H
2O
106 73 44
x y 4.4g

x=10.6g y=7.3g
(1)样品的纯度为
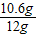
×100%=88.3%;
(2)所取盐酸的溶质质量分数至少为:

=7.3%;
答:(1)纯碱样品的纯度是88.3%;(2)所取盐酸的溶质质量分数至少为7.3%;
点评:本题考查学生利用化学反应方程式的计算,利用二氧化碳的质量代入计算是关键.


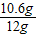 ×100%=88.3%;
×100%=88.3%; =7.3%;
=7.3%;

