
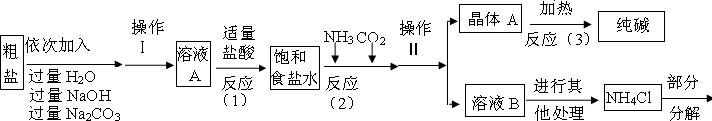
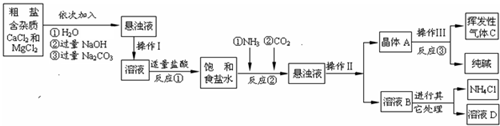
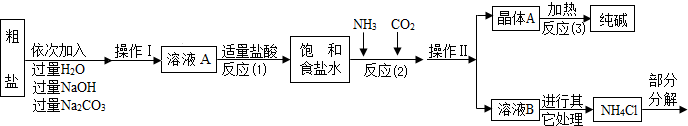
某校化学兴趣小组参观碱式碳酸镁的生产后,知道了以水氯镁石(主要成分为MgCl2·6H2O)为原料生产碱式碳酸镁[xMgCO3·yMg(OH)2·zH2O]的主要流程如下:

【问题讨论】
(1)上述流程中滤液的主要溶质(写化学式) ,检验其中阳离子要用的试剂有(填序号) 。
A. 氧化钙 B. 稀盐酸 C. 紫色石蕊试液 D. 硫酸钠溶液
(2)上述流程中NH3被循环使用,流程中生成NH3的化学方程式为 。
(3)流程中“加热” 这一环节每生成l个分子xMgCO3·yMg(OH)2·zH2O需消耗氨的分子数为 (用代数式)。
(4)判断碱式碳酸镁是否洗涤干净,可以采取向最后的洗出液中滴加(填序号) ,然后观察现象判断。
A. 盐酸和氯化钡的混合液 B. 硝酸和硝酸银的混合液 C.碳酸钠溶液 D.稀盐酸
【组成探究一】
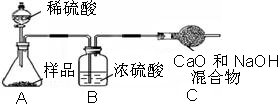
(5)已知高温煅烧碱式碳酸镁得到MgO,用下列装置设计实验测定碱式碳酸镁的组成,装置连接从左到右依次为A→ → →D。
(6)取碱式碳酸镁4.66g,高温煅烧至恒重,得到固体2.00g、CO21.76g,通过计算确定碱式碳酸镁的化学式为 。(2分)。
计算过程(3分)
【组成探究二】
(7)有同学对用盐酸有异议,认为用硫酸更好。你的看法是(填序号) ;
A.同意 B. 不同意 C. 不确定
你的理由是 。
(8)称得的溶液质量为 g [提示:可用⑹中数据]
【组成探究三】
更为精确的测量碱式碳酸镁受热分解过程中时间与剩余固体质量,作出如下的坐标图
(9)试回答
①加热时,该晶体开始发生化学变化的时刻是 (填“t1”、“t3”或“t5”)。
②t4~t5时间段固体为(写化学式) 和MgO的混和物。
③t2~t3时间段固体的化学式为(用含x、y的化学式也算对) 。
(1) NH4Cl AC (2) 2NH4Cl+ CaO = CaCl2 + 2NH3↑+ H2O (3) 2(x+y)
(4)B (5)CB (6) 4MgCO3·Mg(OH)2·4H2O ;过程分步给分( 3分)
(7)A 关键词: HCl 挥发逸出 (8)22.9
(9) ① t1 ②Mg(OH)2 ③xMgCO3·yMg(OH)2或4MgCO3·Mg(OH)2
解析试题分析:【问题讨论】
(1)根据反应流程可知,在氯化镁溶液中加入氨气和二氧化碳后,反应生成碱式碳酸镁,再根据质量守恒定律中的元素守恒可知,反应的另一生成物应为氯化铵,即NH4Cl;根据流程图中的滤液加氧化钙,能反应放出氨气可知,要检验其阳离子——铵根离子,可取少量该物质放入试管中,加入少量氧化钙,并在酒精灯火焰上微热,然后将其产生的气体通入紫色石蕊试液,若石蕊变蓝色,则能证明被检物中含有铵根离子。故选AC
(2)根据流程图,结合复分解反应的规律可知,氯化铵与氧化钙反应,生成了氯化钙、氨气和水,故流程中生成NH3的化学方程式为2NH4Cl+ CaO = CaCl2 + 2NH3↑+ H2O。
(3)根据化学变化中的原子种类和个数不变分析,流程中“加热” 这一环节, 每生成l个分子xMgCO3·yMg(OH)2·zH2O需消耗氨的分子数为2(x+y)。
(4)若碱式碳酸镁没洗涤干净,则最后的洗出液中会含有氯化铵,故可向其中滴加硝酸和硝酸银的混合液,则会出现不溶于酸的白色氯化银沉淀。故选B
【组成探究一】
(5)根据题意,结合图示可知,要通过实验测定碱式碳酸镁的组成,需测定反应生成的二氧化碳和水的质量,由于从澄清石灰水中出来的气体会携带水,会影响实验结果的测定,故要先吸收测定水的质量,因此装置连接从左到右依次为A→C→B→D。
(6)根据题意,碱式碳酸镁高温煅烧,生成氧化镁、水和二氧化碳,结合题意可知,碱式碳酸镁4.66g反应生成氧化镁2.00g,二氧化碳1.76g,则根据质量守恒定律可知,生成水的质量为4.66g-2.00g-1.76g=0.9g;由此可知,m(MgO):m(CO2):m(H2O)="2.00g:" 1.76g: 0.9g=100:88:45;可将xMgCO3·yMg(OH)2·zH2O变形成(x+y)MgO·xCO2·(y+z)H2O,则有40(x+y):44x:18(y+z)= 100:88:45,解得x:y:z=4:1:4,即碱式碳酸镁的化学式为4MgCO3·Mg(OH)2·4H2O。
【组成探究二】
(7)由于盐酸具有挥发性,会挥发逸出氯化氢气体,故称量的溶液的质量会偏小,不如用硫酸。
(8)根据题意可知,碱式碳酸镁与酸反应能生成氯化镁和二氧化碳气体,根据质量守恒定律中的元素守恒,结合(6)可知,4.66g碱式碳酸镁与酸反应生成的二氧化碳的质量也应为1.76g,则溶液质量为4.66g +20g-1.76g=22.9g。
【组成探究三】
(9)①根据图示可知,加热时,该晶体在t1前质量没有变化,即没有反应,t1时质量开始减小,说明开始发生化学变化。
③根据题意,结合碱式碳酸镁的化学式4MgCO3·Mg(OH)2·4H2O分析,4.66g碱式碳酸镁受热分解过程中,在t1~t2时间段,减少的质量最终为4.66g-3.94g=0.72g,恰好为其结晶水的质量,由此可知,在该时间段,碱式碳酸镁开始反应失去结晶水,而在t2~t3时间段质量不再减少,即说明此时结晶水已完全失去,故此时固体为4MgCO3·Mg(OH)2。
②在t3~t4时间段,减少的质量最终为3.94g-2.18g=1.76g,恰好为反应生成的二氧化碳的质量,由此可知,在该时间段,4MgCO3·Mg(OH)2开始反应并放出二氧化碳气体,至t4~t5时间段,剩余固体的质量又不再减少了,即说明此时MgCO3已完全反应生成氧化镁和二氧化碳,故此时固体为Mg(OH)2和MgO的混和物。
考点:证明铵盐(NH4+检验方法),Cl-的检验方法,实验方案的设计与评价,实验探究物质的组成成分以及含量,书写化学方程式,质量守恒定律及其应用,有关化学式的计算
点评:对于探究型实验探究,要熟悉实验探究的环节和方法,精心设计实验方案,将所学过探究物质的性质或变化规律的技巧迁移至此,进行细心地探究实验和观察现象,再通过分析实验现象,推断、总结出该物质的性质或变化规律等。


 智慧小复习系列答案
智慧小复习系列答案科目:初中化学 来源: 题型:阅读理解
 小心蒸发,并将所得物质干燥、冷却至室温后称得固体质量为13.1g.样品中碳酸钠的质量分数为
小心蒸发,并将所得物质干燥、冷却至室温后称得固体质量为13.1g.样品中碳酸钠的质量分数为查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| ||
| 物质 | NaCl | NaHCO3 | NH4Cl | NH3 | CO2 |
| 溶解度 | 36.0g | 9.6g | 37.2g | 710 | 0.9 |
| 实验一 | 实验二 | 实验三 | 实验四 | |
| 固体混合物溶液质量 | 100g | 100g | 100g | 100g |
| 加入CaCl2溶液质量 | 10g | 20g | 30g | 40g |
| 生成的沉淀的质量 | 4g | m | 10g | 10g |
| 工业纯碱标准:(Na2CO3% ) | |||
| 优等品 | 一等品 | 合格品 | 次品 |
| ≥95 | ≥80 | ≥75 | ≤40 |
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

| ||
| 物质 | NaCl | NaHCO3 | NH4Cl | NH3 | CO2 |
| 溶解度 | 36.0g[ | 9.6g | 37.2g | 710 | 0.9 |
| ||
| ||
查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| ||
| ||
| ||
| 实验步骤 | 实验现象 | 实验结论 |
取少量样品中的一种放入试管中,塞上带导管的单孔塞,导管另一端伸入澄清石灰水中.加热固体并观察现象. 取少量样品中的一种放入试管中,塞上带导管的单孔塞,导管另一端伸入澄清石灰水中.加热固体并观察现象. |
产生无色气泡,澄清石灰水变浑浊 产生无色气泡,澄清石灰水变浑浊 |
该样品是NaHCO3否则是Na2CO3 该样品是NaHCO3否则是Na2CO3 |

查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com