石灰石的主要成分为碳酸钙(杂质不反应也不溶解),欲测定石灰石样品中碳酸钙的质量分数.请回答下列问题
(1)欲配制300g7.3%的稀盐酸,需36.5%的浓盐酸质量为________g;
(2)将石灰石粉碎加入稀盐酸发生反应的化学方程式为________;
(3)称取37.5g石灰石粉末放在烧杯中,向其中加入300g刚配制的稀盐酸,恰好完全反应,则求解石灰石中碳酸钙质量(X)的比例式为________;
(4)生成二氧化碳的质量为________g;
(5)将反应后所得溶液蒸发掉16.8g水,仍得不饱和溶液则最终溶液中溶质的质量分数为________.
解:(1)设需要浓盐酸的质量为x
300g×7.3%=x×36.5%
解之得:x=60g
故答案为:60
(2)碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,化学方程式为:CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑;
故答案为:CaCO
3+2HCl=CaCl
2+H
2O+CO
2↑;
(3)设该样品中参加反应的碳酸钙质量为x,生成二氧化碳的质量为y反应生成氯化钙的质量为z;
CaCO
3 +2HCl=CaCl
2 +H
2O+CO
2↑
100 73 111 44
x 300g×7.3% z y
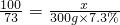
;
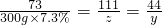
解之得:y=13.2g;z=33.3g;x=30g30g
(4)生成二氧化碳的质量为13.2故答案为:13.2,
(5)反应后所得溶液中溶质的质量分数为:
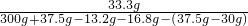
×100%=11.1%
故答案为:11.1%
分析:(1)加水稀释时,稀释前后浓、稀溶液中的溶质质量不变.可根据这一特点建立方程解决问题.
(2)碳酸钙与盐酸反应生成氯化钙、水和二氧化碳.据此写出化学方程式即可;
(3)根据已知条件和300g7.3%的稀盐酸的质量,然后根据碳酸钙与盐酸反应的化学方程式和氯化氢的质量,即可得出求解该样品中参加反应的碳酸钙质量(x)的比例式;
(4)根据碳酸钙与盐酸反应的化学方程式和氯化氢的质量可求得二氧化碳的质量;
(5)根据溶质质量一定,利用溶质质量分数公式进行计算即可.
点评:本题主要考查学生利用化学方程式和溶质质量分数公式进行计算的能力.

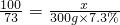 ;
;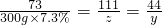
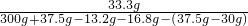 ×100%=11.1%
×100%=11.1%

 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案