
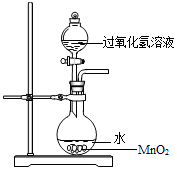
 用过氧化氢制氧气时,有同学对事先在烧瓶中加水产生了疑问.他提出了猜想:
用过氧化氢制氧气时,有同学对事先在烧瓶中加水产生了疑问.他提出了猜想:| 实验 | 1 | 2 | 3 | 4 | 5 |
| 过氧化氢溶液溶质质量分数 | 1% | 3% | 5% | 10% | 15% |
| MnO2粉末用量/克 | 0.5 | 0.5 | 0.5 | 0.5 | 0.5 |
| 收集到500mL气体时所用时间/秒 | 560 | 186 | 103 | 35 | 12 |
| 反应后液体温度/℃ | 26 | 38 | 43 | 59 | 71 |
分析 (1)依据双氧水分解制氧气的产物及条件书写方程式即可;
(2)分析表中的数据要研究一种条件对化学反应的影响,就要保持其它条件不变,只改变要研究的条件,观察对其对实验结果的影响,由表中收集到500ml气体所用时间的长短可得到解答.
(3)依据过氧化氢溶质质量分数越低反应后溶液的温度也越低,可猜想加入水时可能对反应后溶液有降温作用.
解答 解:(1)双氧水在二氧化锰做催化剂的情况下可分解生成水和氧气,其方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;
(2)由表中数据可知,其它条件不变的情况下,双氧水溶质质量分数越高生成500mL氧气所用的时间越短,即反应速度越快,但反应所用的时间与溶质质量分数不成比例,所以此规律因该是在一定范围内成立;
(3)由表中数据可知,溶质质量分数越小的过氧化氢溶液反应后溶液的温度越低,即加水越多反应后溶液的温度越低,所以可猜测加水可以对溶液降温;
故答案为:(1)2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;(2)一定范围内,过氧化氢溶质质量分数越大反应速度越快;(3)给溶液降温.
点评 此题是对双氧水制氧气的探究,分析时采用控制变量的方法对问题进行分析是解决此类题常用的方式.


 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
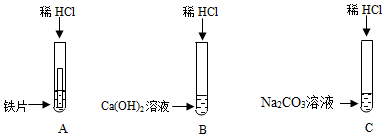
 物质之间发生化学反应时常伴随有明显的现象,但有些化学反应却观察不到明显的现象.某班同学为证明NaOH能与稀盐酸发生中和反应,从不同角度设计了如下实验方案,并进行实验.
物质之间发生化学反应时常伴随有明显的现象,但有些化学反应却观察不到明显的现象.某班同学为证明NaOH能与稀盐酸发生中和反应,从不同角度设计了如下实验方案,并进行实验.查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量滤液于试管中,向其中滴加无色酚酞试液 | 无色酚酞试液变红 | 猜想成立 |
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
| 编号 | 0.25%淀粉溶液(ml) | 蒸馏水(ml) | 0.9%Na2SO4溶液(ml) | 0.9%CuSO4溶液(ml) | 唾液溶液(ml) | 加入碘液 3滴后现象 |
| 1 | 3 | 2 | - | - | - | 变蓝 |
| 2 | 3 | 1 | - | - | 1 | 不变蓝 |
| 3 | 3 | - | 1 | - | 1 | 不变蓝 |
| 4 | 3 | - | - | 1 | 1 | 变蓝 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com