在4g镁粉、碳酸镁和硫酸镁的混合物中,加入稀硫酸20g恰好完全反应,共产生0.54g气体.将产生的气体通入足量的氢氧化钠溶液后,气体减少到0.1g.计算反应所得溶液的溶质质量分数.________.
39.05%
分析:镁粉、碳酸镁和硫酸镁的混合物中,加入稀硫酸会生成二氧化碳与氢气,通入到氢氧化钠后气体减小到0.1g则该气体是氢气,减小的部分则是二氧化碳,利用氢气与二氧化碳的质量可求两反应的硫酸镁的质量,同样可求镁的原混合物中硫酸镁的质量,进而可得溶液的溶质质量分数.
解答:根据题意,生成的0.54克气体中,有H
2和CO
2,而将产生的气体通入氢氧化钠溶液中,气体减少到0.1克,说明H
2质量为0.1克,而CO
2质量为0.44克.
根据化学方程式或关系式可得.
Mg+H
2SO
4=MgSO
4+H
2↑ MgCO
3+H
2SO
4=MgSO
4+H
2O+CO
2↑
24 120 2 84 120 44
X Y 0.1g M N 0.44g
列比例,解得
X=1.2g Y=6g M=0.84g N=1.2g
反应前硫酸镁的质量为:4-1.2-0.84=1.96g
反应后硫酸镁的总质量为:1.96+6+1.2=9.16克
反应后所得溶液的质量分数=
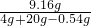
×100%=39.05%
故答案为:39.05%
点评:此题是一道综合计算题,解题的关键是能分清反应的具体过程,并对相关气体的性质及具体反应有较清晰地认识,找到已知量去求未知量然后依据溶质质量分数的计算要求进行计算.

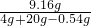 ×100%=39.05%
×100%=39.05%