
| ||
| △ |
| 149 |
| 96 |
| x |
| 9.6g |
| 74.5 |
| 14.9g |
| 143.5 |
| y |
| 101 |
| z |
| 20.2g |
| 100g+130.7g-28.7g |


科目:初中化学 来源: 题型:
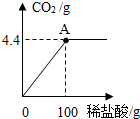 (2011?梧州)广西具有丰富的石灰石资源.化学兴趣小组欲测定某石灰石样品中CaCO3的质量分数,取石灰石样品15g,加入适量稀盐酸(杂质不溶于水,也不与盐酸反应),消耗稀盐酸的质量与放出二氧化碳的质量关系如图所示,请你计算:
(2011?梧州)广西具有丰富的石灰石资源.化学兴趣小组欲测定某石灰石样品中CaCO3的质量分数,取石灰石样品15g,加入适量稀盐酸(杂质不溶于水,也不与盐酸反应),消耗稀盐酸的质量与放出二氧化碳的质量关系如图所示,请你计算:查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解
| ||
| 实验操作 | 实验现象 | 实验结论 |
| 取实验后的滤渣放入试管中,加入适量浓盐酸并加热 | 滤渣仍为MnO2 |
| ||
| ||
| ||
| ||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com