
| ||
| ||
| ||
| 160 |
| x |
| 44 |
| 1.1g |
| 64 |
| 64+16 |
| 3.2g |
| 20g |
| 80 |
| 4g |
| 160 |
| y |
| 8g |
| 4g+96g |


 �ʰ�Ӣ��ͬ����ϰ��ϵ�д�
�ʰ�Ӣ��ͬ����ϰ��ϵ�д� ѧϰʵ����ϵ�д�
ѧϰʵ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
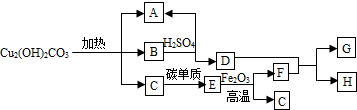
 ����ȸʯ������Ҫ�ɷ��Ǽ�ʽ̼��ͭ[Cu2��OH��2CO3]������һ����Ҫ��ͭ��ʯԭ�ϣ����ȿɷֽ�Ϊ���ֳ����Ļ��������ת����ϵ��ͼ������A�������Һ̬���ʣ�B�Ǻ�ɫ���壬F��GΪ�������ʣ������ƶϻش��������⣺
����ȸʯ������Ҫ�ɷ��Ǽ�ʽ̼��ͭ[Cu2��OH��2CO3]������һ����Ҫ��ͭ��ʯԭ�ϣ����ȿɷֽ�Ϊ���ֳ����Ļ��������ת����ϵ��ͼ������A�������Һ̬���ʣ�B�Ǻ�ɫ���壬F��GΪ�������ʣ������ƶϻش��������⣺�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��2013?��������ģ����1��ijͬѧ��ʵ�������кͷ�Ӧʵ�飬�ý�ͷ�ι���ȡ10%��ϡ������μ��뵽ʢ������������Һ���ձ��У�
��2013?��������ģ����1��ijͬѧ��ʵ�������кͷ�Ӧʵ�飬�ý�ͷ�ι���ȡ10%��ϡ������μ��뵽ʢ������������Һ���ձ��У��鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��CuO | B��CuCl2 | C��Cl2 | D��CuCl |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com