(2010?连云港)某研究性学习小组同学在学习了酸、碱、盐的知识后,走进化学实验室.邀请你参加以下活动.(已知:①2Na
2CO
3+H
2SO
4═2NaHCO
3+Na
2SO
4,NaHCO
3溶液呈碱性;②CaSO
4微溶,但在稀溶液中看作可溶,其水溶液呈中性.)
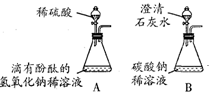
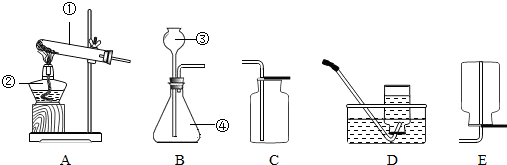
(1)甲、乙两同学想用实验证明稀硫酸和NaOH稀溶液确实能发生反应,设计了如图A所示的实验.
丙、丁两同学想再现课本上将“澄清石灰水滴入Na
2CO
3溶液”的实验现象,设计了如图B所示的实验.并各自进行操作.
【问题讨论】:教师首先肯定了这四位同学的实验设计和操作,请你填空:
甲、乙同学将较多量的稀硫酸加入锥形瓶后,他们是依据溶液的颜色由
红
红
色变为
无
无
色的现象来判断两者确实发生反应的.丙、丁同学的实验中发生的复分解反应可用化学方程式表示为
Na2CO3+Ca(OH)2═CaCO3↓+2NaOH
Na2CO3+Ca(OH)2═CaCO3↓+2NaOH
.
【意外发现1】:甲同学和丙同学在洗刷仪器前,将A、B装置锥形瓶中的残留物倒入同一个洁净的废液缸,发现白色沉淀溶解,有气泡产生,废液缸中形成无色溶液.这一现象立刻引起了同学们的好奇,于是,他们又以“无色溶液中含有哪些溶质”为课题进行探究.
【提出猜想】:经讨论呈现出如下猜想:
①溶质为:Na
2SO
4、CaSO
4 ②溶质为:Na
2SO
4、CaSO
4、H
2SO
4③溶质为:Na
2SO
4、CaSO
4、NaOH
【请你判断】:上述猜想中不合理的是
③
③
(填数字代号).
【实验探究】:小组同学针对认为合理的猜想,设计实验进行探究,请你将下表补充完整.
| 实验内容 | 实验现象和结论 |
取废液缸中少量溶液于试管中,
滴入少量Na2CO3 Na2CO3 溶液,观察 | a.若有气泡产生,则猜想 ② ② 成立(填数字代号) |
| b.若无气泡产生,则猜想 ① ① 成立(填数字代号) |
【意外发现2】:乙同学和丁同学在洗刷仪器前,将A、B装置锥形瓶中的残留物倒入另一个洁净的废液缸,发现沉淀不溶,没有气泡,上层清液呈红色,此时,上层清液中溶质的组成情况可能有许多组,如:①Na
2SO
4、NaOH;②Na
2SO
4、Ca(OH)
2;③Na
2SO
4、NaOH、Na
2CO
3;④Na
2SO
4、
Na2CO3
Na2CO3
;⑤Na
2SO
4、Na
2CO
3、
NaHCO3
NaHCO3
.(未列全.请用化学式将④、⑤补充完整)
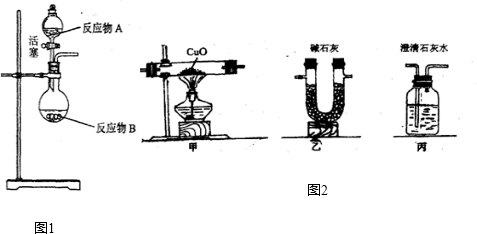
(2)【教师点拨】:证明稀硫酸和NaOH稀溶液确实能发生反应的方法还有多种.
【拓展探究】:小组同学用其他装置继续进行实验.请你回答下列问题:
①若不加酚酞试液,将稀硫酸(适量)与NaOH稀溶液混合后,再向其中加入CuSO
4溶液,无蓝色沉淀生成,则
能
能
(填“能”或“不能”)证明两者确实发生了反应.
②若不加酚酞试液,将稀硫酸(少量)与V
1mL NaOH稀溶液?昆合后,再向其中加入CuSO
4溶液至蓝色沉淀不再产生时,消耗了V
2mL CuSO
4溶液,此时还必须做一个对比实验才能证明两者确实发生了反应,这个对比实验是(简述操作方法及结论):
在V1mLNaOH稀溶液中加入CuSO4溶液至沉淀不再产生时,消耗CuSO4溶液V3mL,若V3>V2即可证明;
在V1mLNaOH稀溶液中加入CuSO4溶液至沉淀不再产生时,消耗CuSO4溶液V3mL,若V3>V2即可证明;
.
还可以将上述CuSO
4溶液换成
FeCl2(或MgCl2等)
FeCl2(或MgCl2等)
溶液等(填一种物质的化学式),同样也可以证明稀硫酸和NaOH稀溶液确实发生了反应.