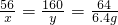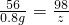将适量的铁粉放入由CuSO4和稀H2SO4组成混合溶液中,铁粉恰好完全溶解,过滤得沉淀物,经洗涤干燥,称得沉淀物的质量与所加入的铁粉的质量相等,求混合溶液中所含CuSO4与H2SO4的质量比是多少?
解:假设生成的铜的质量为6.4g
设与硫酸铜反应的铁的质量为x所含CuSO
4与的质量为y
Fe+CuSO
4═FeSO
4+Cu
56 160 64
x y 6.4g
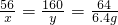
x=5.6g y=16g
那么与硫酸反应的铁的质量为:6.4g-5.6g=0.8g
设混合溶液中所含H
2SO
4的质量为z
Fe+H
2SO
4═FeSO
4+H
2↑
56 98
0.8g z
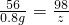
z=1.4g
混合溶液中所含CuSO
4与H
2SO
4的质量比为:16g:1.4g═80:7
答:混合溶液中所含CuSO
4与H
2SO
4质量比为80:7
分析:因为铁粉恰好完全反应无剩余,所以过滤得到的固体就只有铜单质,假设过滤得到的铜为6.4g,那么根据铁和硫酸铜反应的化学方程式,由铜的质量可求出与硫酸铜和与其反应的铁的质量,进而求出与硫酸反应的铁的质量,最后根据铁和硫酸反应的方程式求出硫酸的质量,进而求得质量比.
点评:此题是根据化学方程式的简单计算,涉及的化学方程式有两个,做此题首先需正确写出这两个方程式,然后认真审题获得有利数据来解答此题.