
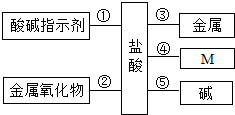
 归纳总结是学习化学的重要方法,小莉同学用如图总结了盐酸与其它物质反应的①~⑤五条化学性质.
归纳总结是学习化学的重要方法,小莉同学用如图总结了盐酸与其它物质反应的①~⑤五条化学性质.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:初中化学 来源: 题型:
| 序号 | 错误结论 | 否定实例 | ||||
| 例: | 燃烧一定有氧气参加 | 2Mg+CO2
| ||||
| ① | 常温下金属都是固体 | |||||
| ② | 物质的溶解度都随温度的升高而增大 | |||||
| ③ | 能生成CO2的反应都可用于实验室制取CO2 |
查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
科目:初中化学 来源: 题型:


查看答案和解析>>
科目:初中化学 来源: 题型:
 归纳总结是学习化学的重要方法,如图是某同学对有关知识的总结,请依据下列几种化合物能通过一步反应转化为含镁化合物M的转化关系填写空格:如图中物质M属于
归纳总结是学习化学的重要方法,如图是某同学对有关知识的总结,请依据下列几种化合物能通过一步反应转化为含镁化合物M的转化关系填写空格:如图中物质M属于查看答案和解析>>
科目:初中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com