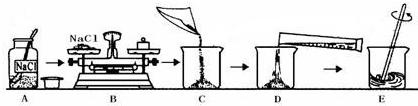
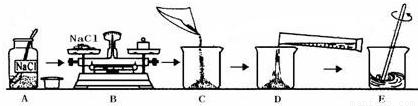
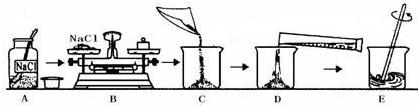
解:(1)在使用药品时,应注意瓶塞倒放;向烧杯内注入水时应沿着烧杯壁注入防止液体溅出,;
(2)根据常用仪器的用途可知:称量一定量的药品用托盘天平,量取一定量的液体用量筒,配制溶液用烧杯,为加速固体溶解用玻璃棒,根据溶质质量分数的计算公式可知50.0g氯化钠溶液中氯化钠的质量分数为
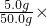
100%=10%;
(3)溶液稀释过程中溶质的质量不变,设需要为25%的浓氯化钠溶液质量为x,可得150.0g×16%=x×25%,解得x=96.0g,需要加入水的质量为150.0g-96.0g=54.0g.由题目所给数据5.0g可知答案应为96.0;54.0.
故答案为:
(1)A操作中,药品瓶塞没有倒放(或 D操作水没有沿着烧杯壁注入可能引起液体溅出);
(2)托盘天平;烧杯;量筒;玻璃棒;
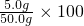
%10%;
(3)96.0;54.0.
分析:明确配制溶液的操作步骤是:计算→称量→溶解→装瓶→贴签→入柜.主要考查一定溶质质量分数的溶液的配制的前三步、仪器的选用、实验操作及误差分析.在使用药品时,应注意瓶塞倒放;向烧杯内注入水时应沿着烧杯壁注入防止液体溅出,;溶解时要用玻璃棒搅拌加速固体溶解;由溶质质量分数的计算公式

×100%,×可知50.0g氯化钠溶液中氯化钠的质量分数;在溶液稀释过程中溶质的质量不变,由此可知所需氯化钠溶液的质量和需要水的质量.
点评:本题考查了配制一定质量分数的溶液的实验中仪器的选取、实验操作及误差分析、溶质质量分数的计算,既考察了基本操作,又考查了学生分析、解决问题的能力.

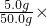 100%=10%;
100%=10%; 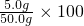 %10%;
%10%;  ×100%,×可知50.0g氯化钠溶液中氯化钠的质量分数;在溶液稀释过程中溶质的质量不变,由此可知所需氯化钠溶液的质量和需要水的质量.
×100%,×可知50.0g氯化钠溶液中氯化钠的质量分数;在溶液稀释过程中溶质的质量不变,由此可知所需氯化钠溶液的质量和需要水的质量.

 阅读快车系列答案
阅读快车系列答案