
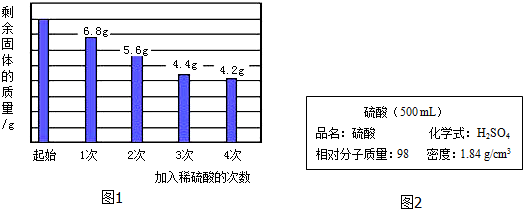
分析 (1)由前三次所加稀硫酸后固体剩余物的质量可得出,每次加入稀硫酸充分反应后固体质量减少1.2g,而第4次加入等量稀硫酸充分反应后固体质量只减少4.4g-4.2g=0.2g小于1.2g,说明固体中能与稀硫酸反应的金属已完全反应,剩余的全部为不能与硫酸反应的金属铜;
(2)根据金属与酸反应的化学方程式,由消耗金属与硫酸的质量,计算出金属的相对原子质量并判断金属元素;再利用硫酸的质量计算生成的硫酸盐的质量及反应放出氢气的质量;最后利用所得溶液中溶质的质量分数=$\frac{生成的硫酸盐的质量}{反应后溶液的质量}$×100%,计算出溶液的质量分数;其中反应后溶液质量可利用质量守恒定律求出.
(2)利用稀释前后溶质的质量不变列方程解决.
解答 解:(1)混合物中Cu的质量分数=$\frac{4.2g}{8g}$×100%=52.5%
(2)设M金属单质的相对原子质量为X,所得溶液中MSO4的质量为y,生成H2的质量为z.
第3次加入稀硫酸充分反应后,前三次共消耗金属的质量=8.0g-4.4g=3.6g,
前三次共消耗硫酸的质量=$\frac{140.0g}{4}$×3×14%=14.7g
M+H2SO4═MSO4+H2↑
x 98 x+96 2
3.6g 14.7g y z
则$\frac{x}{3.6g}=\frac{98}{14.7g}$,解得x=24,可判断该金属是镁;
则$\frac{98}{14.7g}$=$\frac{24+96}{y}$,解得y=18g,
则$\frac{98}{14.7g}$=$\frac{2}{z}$,解得z=0.3g,
MSO4溶液的质量分数为$\frac{18g}{105g+3.6g-0.3g}$×100%≈16.6%.
(3)设100g这种浓硫酸稀释为质量分数为14%的硫酸,需要水的质量为x.
100g×98%═(100g+x)×14%,解得x═600g.
答:现要将100g这种浓硫酸稀释为质量分数为实验所用的稀硫酸,需要加水的质量是600g.稀释时应注意事项将浓硫酸慢慢倒入水中,并不断搅拌.
故答案为:
(1)52.5%; (2)确定是镁; 16.6%;(3)600克;将浓硫酸慢慢倒入水中,并不断搅拌.
点评 反应后所得溶液的质量可根据质量守恒定律进行计算,反应后溶液的质量=前三次所加稀硫酸的质量+前三次反应消耗金属的质量-反应放出氢气的质量.


 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:初中化学 来源: 题型:选择题
| A. | 催化剂不能改变生成物的质量 | |
| B. | 催化剂只能加快化学反应速率,但本身的性质不变 | |
| C. | 没有催化剂就不能进行化学反应 | |
| D. | 二氧化锰可作任何反应的催化剂 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 它们之间的转化是物理变化 | B. | 它们之间的转化是化学变化 | ||
| C. | 它们同属于一种物质 | D. | 它们的性质完全相同 |
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| A. | 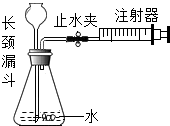 中注射器用于气密性检查,缓慢向外拉活塞,若长颈漏斗内有液面上升,则气密性良好 | |
| B. | 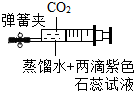 中注射器作反应容器,夹紧弹簧夹振荡,紫色石蕊变红,则CO2与水反应有酸性物质生成 | |
| C. | 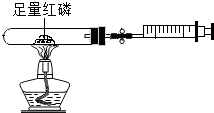 中的注射器可用于气体体积的测量,该装置测量的是红磷燃烧后试管中剩余气体的体积 | |
| D. |  中的注射器代替了分液漏斗,实验室用此装置制氧气时,三角烧瓶内盛放的是氯酸钾 |
查看答案和解析>>
科目:初中化学 来源: 题型:选择题
| 熔点/℃ | 密度/(g/cm3) | 硬度(以金刚石的硬度为10作标准) | 异电性(以银的导电性为100作标准) | 耐腐蚀性 | |
| 某合金 | 2500 | 3.00 | 7.4 | 2.3 | 耐腐蚀 |
| 铁 | 1535 | 7.86 | 4.5 | 17 | 不耐腐蚀 |
| A. | 机械零件 | B. | 门窗 | C. | 保险丝 | D. | 飞机外壳 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com