
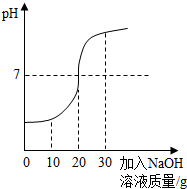
 (2012?宁德)化学兴趣小组对某工业废水(含有H2SO4、Na2SO4)中H2SO4的含量进行测定.甲、乙两同学各提出不同的测定方法:
(2012?宁德)化学兴趣小组对某工业废水(含有H2SO4、Na2SO4)中H2SO4的含量进行测定.甲、乙两同学各提出不同的测定方法:| 98 |
| x |
| 80 |
| 2g |


 阶梯计算系列答案
阶梯计算系列答案科目:初中化学 来源: 题型:
| 温度/℃ | 20 | 30 | 50 | 60 | 80 | |
| 溶解度/g | K2CO3 | 110 | 114 | 121 | 126 | 139 |
| KNO3 | 31.6 | 45.8 | 85.5 | 110 | 169 | |
查看答案和解析>>
科目:初中化学 来源: 题型:
| 物质 | 盐酸 | 干冰 | 烧碱 | 食盐 |
| 化学式 | HCl | CO2 | NaOH |
查看答案和解析>>
科目:初中化学 来源: 题型:
 (2012?宁德质检)A、B、C是三种不同类别的物质,都含有一种相同的元素,这三种物质和CaCl2的转化关系如图所示(“→”表示在一定条件下能发生转化).
(2012?宁德质检)A、B、C是三种不同类别的物质,都含有一种相同的元素,这三种物质和CaCl2的转化关系如图所示(“→”表示在一定条件下能发生转化).查看答案和解析>>
科目:初中化学 来源: 题型:阅读理解

| ||
| ||
| 实验步骤 | 现象 | 结论 |
收集一试管气体, 收集一试管气体, 用带火星木条检验 用带火星木条检验 |
木条不复燃 | 该气体不是氧气 |
| 收集一试管气体,用拇指堵住管口,移近酒精灯火焰 | 发出轻微的爆鸣声,并产生淡蓝色火焰 | 该气体是 氢气 氢气 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com