
【题目】某课外兴趣小组设计利用废旧干电池中的锌皮和未知浓度的稀盐酸制取纯净、干燥的氢气, 并验证气体中是否含有杂质。实验装置图如下:
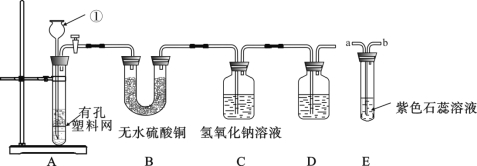
【查阅资料】无水硫酸铜遇水变蓝色
(1)装置 A 中仪器①的名称是 ; 写出发生反应的化学方程式 。
(2)实验中看到 B 中无水硫酸铜变蓝色, 说明产生的气体中含有杂质水。为了检验气体中还可能存在的杂质, 可将 E 装置连接到上述装置 ( 填序号) 之间, 气体从 (填 a 或 b) 进入装置 E 。
(3)D 装置中的试剂是 ( 写出名称) 。
(4)下列收集氢气的方法中符合题意的是 。
A.排水法 B.向下排空气法 C.干瘪的塑料袋 D.塑料瓶
【答案】(1)长颈漏斗;Zn+2HCl══ZnCl2+H2↑ ;(2)BC ,a (3)浓硫酸(4)C
【解析】(1)由图可知,仪器①是长颈漏斗;锌和稀盐酸反应生成氯化锌和氢气,反应的化学方程式表示为Zn+2HCl══ZnCl2+H2↑;(2)由于稀盐酸的浓度是未知的,若盐酸的浓度过大,就会挥发出氯化氢气体,氯化氢气体溶于水形成盐酸,盐酸呈酸性,能使紫色的石蕊试液变成红色,故要检验是否含有氯化氢气体,可将E装置连接在B、C装置之间,气体从a端通入可使气体与紫色石蕊充分接触;(3)该实验的目的是要得到纯净、干燥的氢气,故最后要对氢气进行干燥,液态干燥剂是浓硫酸;(4)A、用排水法收集的氢气不干燥,错误;B、用向下排空气法收集的氢气不纯净,可能含有少量的氧气,错误;C、干瘪的塑料袋中不含空气,正确;D、塑料瓶收集的氢气可能不纯净,错误。故选C。


科目:初中化学 来源: 题型:
【题目】南海、钓鱼岛及其附属海域是我国固有领土,蕴藏着丰富的海洋资源,我国制碱工业先驱侯德榜发明了“侯氏制碱法”,在充分利用海洋资源的基础上,结合“侯氏制碱法”的基本原理,可模拟实现工业生产纯碱的过程如下(某些反应产物以略去):

回答下列问题:
(1)操作a的名称是_______________。
(2)反应②的化学方程式为________________________。
(3)反应④的化学方程式为___________________;请列举小苏打在生活中的一种常见用途_______________________。
(4)向精制饱和食盐水中通入两种气体的顺序是:先通氨气形成饱和氨盐水,然后在加压条件下通入二氧化碳。这样操作的目的是___________________________。
(5)仔细观察流程图,其中可循环利用的物质除二氧化碳之外,还有___________。
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列说法中,正确的是
A.家用电器着火立即用水浇灭
B.室内起火,迅速打开所有门窗通风
C.用水灭火,是因为降低了可燃物的着火点
D.厨房煤气管道漏气,迅速关闭阀门并开窗通风
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】下列反应的化学方程式正确的是
A.铁在氧气中燃烧: 2Fe +3O2![]() 2Fe2O3
2Fe2O3
B.硫酸铵与烧碱混合: ( NH4 ) 2 SO4 +2NaOH=Na2SO4 +2H2 O +2NH3 ↑
C.铝片放入硝酸银溶液中: Al + AgNO3=AlNO3 + Ag
D.向氯化镁溶液中滴入硫酸钾溶液: MgCl2 + K2 SO4=MgSO4 ↓ + 2KCl
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】对下列宏观事实的微观解释,不合理的是( )
A.车胎在阳光下爆裂——分子体积变大
B.氧化汞受热后分解——分子在化学变化中可分
C.闻到不远处的花香——分子在不断地运动
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】化学兴趣小组用一瓶久置的过氧化氢溶液制取氧气并测量过氧化氢质量分数。称量68 g过氧化氢溶液和0.1 g二氧化锰进行实验,反应前后质量随时间变化关系如图。计算:

(1)制得氧气的质量是________g。
(2)过氧化氢质量分数是__________?
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】对下列相关问题的解释不正确的是
A.CO和CO2化学性质不同是因为分子构成不同
B.汽油和洗涤剂都能洗去油污是因为二者都具有乳化作用
C.牛奶在夏天比在冬天易变质是因为温度越高化学反应速率越快
D.木炭在氧气中比在空气中燃烧更旺是因为反应物浓度不同反应现象不同
查看答案和解析>>
科目:初中化学 来源: 题型:
【题目】碱式氯化镁【Mg(OH)Cl】受热能分解,它分解后产物是什么?小科进行了探究。
【猜想】Mg(OH)Cl分解后产物可能有:Mg、MgCl2、MgO、HCl气体、H2O、Cl2。
老师告诉他产物就是上述猪想中的其中几种,并提示Cl2是一种黄绿色有刺激性气味的气体。
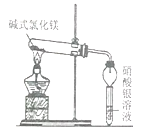
【实验一】取少量的Mg(OH)Cl放入大试管中,按如图所示装置进行实验。加热过程中观察到足量硝酸银溶液中有白色沉淀产生,一段时间后,沉淀不再产生,大试管口也没有液滴形成,管内有固体剩余,无其他现象。由此推知Mg(OH)Cl分解后产物中有_______气体,无其他气体。
【实验二】取少量实验一的剩刹余固体于试管中,加入足量稀盐酸,没有气泡产生。由此推知Mg(OH)Cl分解后产物中没有_______。
【实验三】再取少量实验一的剩余固体,加入足量稀硝酸,固体全部溶解,再滴入AgNO3溶液,无沉淀产生。由此推知Mg(OH)Cl分解后产物中没有________。
【结论】Mg(OH)Cl受热分解的化学反应方程式为____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com