
 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案科目:初中化学 来源: 题型:实验探究题
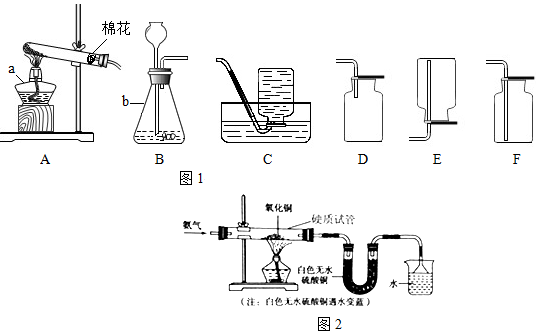
查看答案和解析>>
科目:初中化学 来源: 题型:推断题
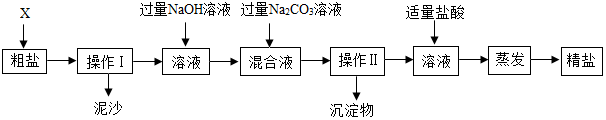
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
查看答案和解析>>
科目:初中化学 来源: 题型:实验探究题
查看答案和解析>>
科目:初中化学 来源: 题型:填空题
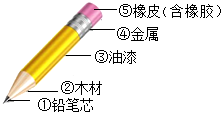
查看答案和解析>>
科目:初中化学 来源: 题型:解答题
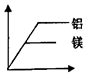 “图象法”可以形象直观地揭示化学变化中的数量关系,分析图象时要注意“点线结合”,关注起点、折点、终点的意义,线段,射线、曲线表示的变化趋势等,请你完成下面的问题:
“图象法”可以形象直观地揭示化学变化中的数量关系,分析图象时要注意“点线结合”,关注起点、折点、终点的意义,线段,射线、曲线表示的变化趋势等,请你完成下面的问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com