某兴趣小组同学在一份资料中了解到:铜有CuO和Cu2O(红色)两种常见的氧化物.因为Cu和Cu2O均为红色,故他们猜测,在H2还原CuO所得的红色产物中可能含有Cu2O.
(1)该小组同学准确称取了8.0g黑色CuO粉末放入大试管中,不断通入足量的H2,在加热条件下进行还原,如果产物只有Cu,其质量应为______.
(2)该小组在H2还原CuO时,当发现8.0g黑色CuO粉末全部转变成红色时,停止加热,冷却后称得固体质量为6.8g.此红色固体中氧元素的质量为______,以此推得Cu2O的质量为______.
解:(1)本题中通入足量的H
2,在加热条件下进行还原,如果固体产物只有Cu,根据元素守恒,CuO粉末是8.0g,那么铜的质量是:8.0g×

×100%=6.4g,即生成铜的质量为6.4g;
(2)根据(1)的解答可以知道固体产物只有铜时,质量是6.4g,而题干中冷却后称得固体质量为6.8g,从而可以判断生成的物质为铜与氧化亚铜的混合物,因此增加的质量是氧元素的质量,氧元素的质量是:6.8g-6.4g=0.4g;而氧元素存在于氧化亚铜中,所以根据氧元素的质量求得氧化亚铜的质量为:0.4g÷
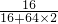
×100%=3.6g.
故答案为:(1)6.4g;
(2)0.4g;3.6g.
分析:(1)根据反应前后铜元素的质量守恒,可以用氧化铜的质量求铜的质量.
(2)冷却后称得固体质量为6.8g,因此有氧化亚铜,与6.4g的差值就是氧元素的质量,从而得到氧化亚铜的质量.
点评:本考点既考查了氢气的还原性和质量守恒定律,在解答时要注意元素守恒思想的运用,有时运用元素守恒可以起到事半功倍的效果.

 ×100%=6.4g,即生成铜的质量为6.4g;
×100%=6.4g,即生成铜的质量为6.4g;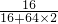 ×100%=3.6g.
×100%=3.6g.
