
某校化学兴趣小组同学用一瓶含有少量氯化钠的硫酸钠固体样品,进行如下图所示的实验。

已知:Na2SO4 + BaCl2 = BaSO4↓ + 2NaCl
请根据以上信息,计算反应后所得溶液中溶质的质量分数。
解:生成BaSO4的质量为:10g + 87g + 54.65g - 140g = 11.65 g
设样品中硫酸钠的质量为x,生成氯化钠的质量为y
Na2SO4 + BaCl2 =BaSO4↓ + 2NaCl
142 233 117
x 11.65g y
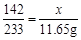
x = 7.1g
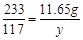
y = 5.85g
反应后溶液中溶质的质量为:(10g-7.1g)+ 5.85g = 8.75g
反应后溶液中溶质的质量分数为: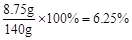
答:反应后所得溶液中溶质的质量分数为6.25%。
【解析】
试题分析:根据质量守恒定律,反应前物质的总质量等于反应后物质的总质量:
Na2SO4的质量+水的质量+ BaCl2溶液的质量= BaSO4沉淀的质量+NaCl质量
BaSO4沉淀不溶于水,不是溶液的质量,故生成BaSO4的质量为:10g + 87g + 54.65g - 140g = 11.65 g
由BaSO4沉淀的质量,列比例式计算出参加反应的硫酸钠的质量7.1g,求出样品中含有NaCl的质量10g-7.1g=2.9 g 再加上生成NaCl的质量就是反应后溶质的总质量:反应后溶液中溶质的质量为:2.9 g + 5.85g = 8.75g
根据溶质的质量分数= ×100%=
×100%=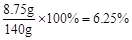
考点:化学方程式的计算、溶质的质量分数计算


 阅读快车系列答案
阅读快车系列答案科目:初中化学 来源: 题型:
 (2012?荔湾区一模)某校化学兴趣小组同学发现,长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁.他们为了测定水垢中碳酸钙的含量,将足量质量分数为10%的盐酸加入到10g水垢中,产生CO2气体的情况如图所示.
(2012?荔湾区一模)某校化学兴趣小组同学发现,长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁.他们为了测定水垢中碳酸钙的含量,将足量质量分数为10%的盐酸加入到10g水垢中,产生CO2气体的情况如图所示. 查看答案和解析>>
科目:初中化学 来源: 题型:
 某校化学兴趣小组同学在实验测定一块大理石中碳酸钙的质量分数.他们称取的大理石质量为12.5g,将其放入足量的稀盐酸中,产生气体的情况如图所示.计算该大理石中碳酸钙的质量分数?(大理石中除碳酸钙之外的其它杂质不与盐酸发生反应)
某校化学兴趣小组同学在实验测定一块大理石中碳酸钙的质量分数.他们称取的大理石质量为12.5g,将其放入足量的稀盐酸中,产生气体的情况如图所示.计算该大理石中碳酸钙的质量分数?(大理石中除碳酸钙之外的其它杂质不与盐酸发生反应)查看答案和解析>>
科目:初中化学 来源: 题型:
| 测定时间(分钟) | 0 | 1 | 2 | 3 |
| pH | 4.73 | 4.62 | 4.56 | 4.55 |
查看答案和解析>>
科目:初中化学 来源: 题型:
 某校化学兴趣小组同学发现,长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁.他们为了测定水垢中碳酸钙的含量,将足量质量分数为10%的盐酸加入到12.5g水垢后,产生CO2气体的情况如图所示.
某校化学兴趣小组同学发现,长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁.他们为了测定水垢中碳酸钙的含量,将足量质量分数为10%的盐酸加入到12.5g水垢后,产生CO2气体的情况如图所示.查看答案和解析>>
科目:初中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com