分析:根据质量守恒定律中的原子个数不变,(1)该化学方程式可用观察法或定一法配平;(2)由于Fe2O3的化学式中氧原子的个数为奇数个,因此该化学方程式可用奇数变偶数的方法配平.
解答:解:根据质量守恒定律中的原子个数不变:
(1)通过观察或定一法,由Fe3O4的1个分子中含有3个铁原子可确定Fe的化学式前的化学计量数为3;
由Fe3O4的1个分子中含有4个氧原子可确定H2O的化学式前的化学计量数为4;
由H2O的化学式前的化学计量数4可确定H2的化学式前的化学计量数也是4.
(2)由于Fe2O3的化学式中氧原子的个数为奇数个,因此首先在Fe2O3的化学式前添加化学计量数2,从而将其化学式中的氧原子个数由奇数变成偶数;
然后再由2个Fe2O3分子中含有4个铁原子可确定FeS2的化学式前的化学计量数为4;
由4个FeS2分子中含有8个硫原子可确定SO2的化学式前的化学计量数为8;
最后再由2个Fe2O3和8个SO2分子中共含有22个氧原子可确定O2的化学式前的化学计量数为11.
故答案为:(1)3;4;1;4.(2)4;11;2;8.
点评:本题主要考查质量守恒定律和化学方程式的配平,难度较小,但能加深学生对质量守恒定律中原子个数守恒的认识和理解,同时也练习和巩固了化学方程式的配平方法.



 教材全解字词句篇系列答案
教材全解字词句篇系列答案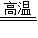 PCl3
PCl3